STAMINALI, CELLULE
Enciclopedia Italiana - IX Appendice (2015)
STAMINALI, CELLULE.
– Cellule staminali embrionali e adulte. Riprogrammazione cellulare e generazione di staminali pluripotenti. Plasticità e rigenerazione. La lotta tra il nucleo e il citoplasma. Medicina rigenerativa. Le cellule staminali nel Terzo millennio. Bibliografia
Tutti gli organismi multicellulari, dagli invertebrati all’uomo, sono formati da moltissimi tipi cellulari con specifiche funzioni biologiche. Per es., nell’uomo le cellule della pelle sono capaci di produrre una barriera biologica per difendere l’organismo dall’ambiente esterno, mentre le cellule dell’osso producono materiale extracellulare costituito da fibre e da sostanze amorfe glicoproteiche per fornire sostegno. Solo le c. s. non possiedono alcuna specializzazione fisiologica, ma racchiudono in sé la capacità sorprendente di generare le cellule specializzate necessarie al funzionamento di ogni organismo (Sampaolesi 2011).
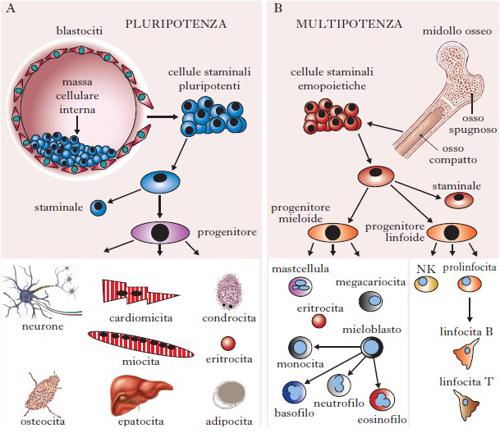
Le c. s. sono presenti in tutti gli organismi viventi e in tutti i tessuti capaci di rigenerare, e devono rinnovarsi e nello stesso tempo avere la possibilità di produrre cellule specializzate grazie alla loro potenza (Beck, Lee, Kim 2015; Goodell, Nguyen, Shroyer 2015). L’autorigenerazione è la capacità di creare una cellula indifferenziata perfettamente identica alla c. s. originaria. La potenza cellulare è invece la capacità di dare origine a tipi cellulari altamente specializzati per specifiche funzioni biologiche. In base alla potenza possiamo distinguere diversi tipi di staminali. La totipotenza è la capacità di dare origine a tutti i tessuti embrionali ed extraembrionali, ed è essenzialmente ristretta ai primissimi stadi della vita embrionale, quando l’embrione è formato da sole 4 o 8 cellule. La pluripotenza è la capacità di differenziare in tutti i tessuti embrionali, tipica delle c. s. embrionali (ESCs, Embryonic Stem Cells) e delle c. s. pluripotenti indotte (iPSCs, induced Pluripotent Stem Cells). La multipotenza è la capacità di uno dei tre foglietti germinativi (endoderma, mesoderma o ectoderma) o di uno specifico tessuto di differenziare in diversi tipi cellulari ed è associata alle c. s. adulte. Infine, l’unipotenza è la capacità di differenziare in un unico tipo cellulare.
Recentemente sono stati individuati piccoli RNA (RiboNucleic Acid) denominati microRNA (miRNA), non codificanti proteine, in grado di regolare molti geni a livello post-trascrizionale e di esercitare effetti pleiotropici (Quattrocelli, Sampaolesi 2015). Una quantità crescente di prove suggerisce che alcuni miRNA hanno un ruolo fondamentale nel mantenimento della pluripotenza/multipotenza nelle staminali e regolano il loro differenziamento (Berardi, Pues, Thorrez et al. 2012).
Cellule staminali embrionali e adulte. – Nei mammiferi ci sono due tipi principali di c. s.: quelle embrionali, localizzate nella massa cellulare interna della blastocisti, e quelle adulte, presenti nei tessuti adulti. Le ESCs sono le uniche popolazioni cellulari capaci di generare tutti i tipi cellulari (Beck, Lee, Kim 2015). Si originano in coltura dal la massa cellulare interna (o embrioblasto) della blastocisti, una struttura sferica che nei mammiferi si forma dopo 4-5 giorni dalla fecondazione dell’oocita. Sono state isolate recentemente, nel 1981 dal topo e nel 1998 dall’uomo, e la loro incredibile capacità di differenziare in tutte le linee cellulari ha stimolato l’interesse per un loro utilizzo come fonte rinnovabile di cellule più specializzate.
Le c. s. adulte (ASCs, Adult Stem Cells) sono presenti in un numero limitato in ogni tessuto e risiedono in aree specifiche controllate biochimicamente dette nicchie staminali (Goodell, Nguyen, Shroyer 2015). In alcuni casi le ASCs rimangono relativamente quiescenti (cellule satelliti del muscolo) e si attivano solamente in risposta a un danno o a uno stato patologico. In altri casi, come nell’epidermide (cheratinociti) o nel midollo osseo (c. s. emopoietiche e mesenchimali), sono sempre in attiva proliferazione.
In vitro e probabilmente anche in vivo vanno incontro a senescenza, perdendo la capacità di proliferare dopo diversi cicli cellulari. Le c. s. adulte mantengono il normale turnover cellulare del tessuto e lo rigenerano in caso di danno, oltre a contribuire allo sviluppo postnatale dell’individuo. Le ASCs e le ESCs si propagano per divisione simmetrica (ogni cellula ne genera due identiche tra loro in ogni divisione) e per divisione asimmetrica (che permette la generazione di una c. s. identica alla cellula di partenza e di una cellula progenitrice in grado di differenziare in tipi cellulari specializzati), come illustrato nella fig. 1. I progenitori possiedono una capacità rigenerativa inferiore a quella delle c. s. di partenza (Beck, Lee, Kim 2015). L’elevata attività telomerasica presente nelle c. s. previene la perdita del materiale genetico nelle numerose divisioni cellulari.
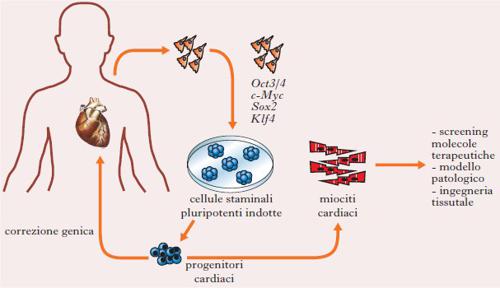
Riprogrammazione cellulare e generazione di staminali pluripotenti. – Le cellule del nostro corpo possono tornare indietro nel tempo e avere caratteristiche simili a quelle della vita embrionale? Sicuramente sì. Possiamo clonare una rana partendo da una cellula somatica di un girino? Sicuramente sì. E per queste meravigliose scoperte, i cui sforzi scientifici sono durati cinquant’anni, nel 2012 gli scienziati John B. Gurdon e Shinya Yamanaka hanno ricevuto il premio Nobel per la fisiologia o la medicina. Sir Gurdon è il padre scientifico della clonazione. Nel 1958 ha clonato il primo essere vivente, una rana, creando un grande scompiglio sul fronte della bioetica (J.B. Gurdon, T.R. Elsdale, M. Fischberg, Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei, «Nature», 1958, 182, 4627, pp. 64-65). In oociti di rana enucleati sono stati inseriti nuclei somatici di girino e circa il 25% di essi ha generato girini capaci di andare incontro a metamorfosi e formare rane geneticamente identiche. Circa cinquant’anni dopo Yamanaka ha inventato una tecnica che permette di avere c. s. pluripotenti da cellule somatiche, senza utilizzare embrioni (fig. 2). Yamanaka e i suoi collaboratori hanno dimostrato che è possibile ottenere progenitori pluripotenti da fibroblasti forzando l’espressione genica di quattro geni: c-Myc, Sox2, Klf4 e Oct3/4 (Takahashi, Yamanaka 2006). La comunità scientifica riconosce a entrambi la scoperta più importante del Terzo millennio e che ha reso possibile invertire il senso di marcia della vita biologica. Altri ricercatori hanno modificato la metodica e identificato altri geni implicati nella riprogrammazione e piccole molecole capaci di attivare questi geni.
Negli ultimi anni questi studi sono stati oggetto di grandi discussioni che hanno abbracciato trasversalmente il mondo scientifico, etico e religioso. Quando si parla di tecnologie avanzate, come appunto l’uso delle c. s., bisogna considerare i grandi capitali economici coinvolti. Spesso presunti esperti nel settore della medicina rigenerativa attirano pazienti affetti da malattie incurabili per trattamenti molto costosi. Questo è il caso di Stamina, una cura basata sul trapianto di staminali di discussa origine, che è stata praticata anche come cura compassionevole nell’ospedale di Brescia. La grande attenzione mediatica ha creato purtroppo false speranze in molti pazienti, nonostante esperti e riviste scientifiche internazionali quali «Nature» avessero condannato il metodo per l’assenza di studi preclinici e la mancanza di una logica scientifica. In Cina, Thailandia, Repubblica di Corea, ma anche nell’Europa dell’Est, dove i controlli sono meno severi, sono nate recentemente moltissime cliniche specializzate nel trattamento di malattie incurabili, dove l’obiettivo prevalente è in realtà favorire i propri interessi economici.
Plasticità e rigenerazione. – La plasticità differenziativa delle cellule è un processo essenziale per la riproduzione, lo sviluppo e la crescita di tutti gli organismi pluricellulari. Il controllo del differenziamento cellulare è stato al centro di un intenso studio negli ultimi decenni. Lo studio delle c. s. naturali e indotte ha aperto un riesame del significato della plasticità cellulare. Le recenti scoperte, così come le nuove manipolazioni sperimentali, hanno eroso molti di questi concetti consolidati e stanno costringendo a una rivalutazione dei sistemi sperimentali e dei paradigmi attualmente utilizzati per esplorare i processi biologici legati a rigenerazione e invecchiamento cellulare.
Tra le staminali pluripotenti murine e umane esistono molte differenze in merito a fattori molecolari e condizioni di coltura, ma entrambe formano aggregati di cellule indifferenziate e differenziate, rappresentative di tutti e tre i foglietti germinativi embrionali: l’endoderma, il mesoderma e l’ectoderma. Queste strutture sferiche sono chiamate corpi embrioidi perché molte delle loro caratteristiche biologiche ricalcano quelle dell’embrione postimpianto e sono utilizzate per studiare il controllo del differenziamento cellulare nello sviluppo precoce. La pluripotenza delle staminali viene testata in topi immunodeficienti nei quali, quando impiantate sotto cute o all’interno della capsula renale, formano teratomi, ossia tumori contenenti cellule differenziate derivanti da tutti e tre i foglietti germinativi embrionali.
In biologia, e in particolare nell’evoluzione biologica, le regole sono fatte per essere infrante e la maggior parte dei progressi evolutivi, se non tutti, è derivata dalla violazione di norme preesistenti. Lo studio delle c. s. e della loro potenza ha avuto importanti ripercussioni nella nostra comprensione della biologia e ci ha costretti a ripensare che cosa significa per cellule e tessuti il differenziamento. Sta diventando sempre più evidente, infatti, che il concetto di differenziamento terminale è biologicamente non accurato. Infatti, anche se la generazione di tipi cellulari completamente maturi e funzionali a partire da staminali pluripotenti umane ha portato avanzamenti scientifici negli ultimi anni, questo processo rimane ancora non del tutto conosciuto e rappresenta una sfida importante. In futuro, l’abilità di dirigere il differenziamento delle c. s. pluripotenti con la massima efficienza verso una desiderata linea cellulare, con sistemi di induzione cellula-cellula o attraverso la combinazione di specifici fattori di crescita, consentirà il loro utilizzo per la scoperta di nuovi farmaci e la riparazione di tessuti danneggiati o malati attraverso il trapianto autologo (Sánchez Alvarado, Yamanaka 2014).
La lotta tra il nucleo e il citoplasma. – Il processo di riprogrammazione nucleare nell’oocita può essere visto come un conflitto tra il citoplasma della cellula uovo, i cui componenti sono destinati a promuovere la replicazione del DNA (DeoxyriboNucleic Acid) e quindi una rapida trascrizione, e il nucleo somatico, la cui funzione è di mantenere uno stato stabile. Il citoplasma di un uovo è appositamente progettato per attivare il nucleo altamente condensato e specializzato di uno spermatozoo con un’efficienza del 100%. Non deve sorprendere che gli stessi componenti siano efficaci nell’attivare il nucleo di una cellula somatica. La differenza è che il nucleo delle cellule somatiche è diventato, durante il processo di differenziamento cellulare, altamente resistente all’attivazione del citoplasma degli oociti. I nuclei delle cellule differenziate sono dotati di molecole che stabilizzano il loro stato differenziato e resistono all’inversione cellulare o ringiovanimento. Se i nuclei delle cellule differenziate fossero capaci di modificarsi a uno stato embrionale, questo potrebbe permettere l’inversione del differenziamento e generare difetti cellulari responsabili dell’induzione tumorale. Il lavoro sperimentale condotto da Gurdon è stato concentrato sull’utilizzo delle uova di anfibi per l’abbondanza di materiale e la pronta disponibilità, un vantaggio che era molto conosciuto dai biologi dello sviluppo fin dal 1950. I principi generali che sono emersi dal lavoro sugli anfibi sono stati applicati ai mammiferi, fino alla clonazione della pecora Dolly (Campbell, McWhir, Ritchie et al. 1996). Dolly è stata generata da Keith Campbell nel 1996, al Roslin Institute in Scozia, dove ha vissuto fino alla sua morte avvenuta circa sette anni dopo, a causa di complicazioni dovute a un’infezione polmonare. Una piena comprensione della riprogrammazione nucleare negli anfibi potrebbe agevolare la riprogrammazione nucleare nei mammiferi, uomo compreso, e quindi contribuire all’eventuale applicazione terapeutica della sostituzione cellulare (Gurdon 2013).
Medicina rigenerativa. – Molte malattie attualmente incurabili, come la distrofia muscolare, la cardiomiopatia ipertrofica e il diabete mellito giovanile, sono causate dalla morte o disfunzione di uno solo o di pochi tipi cellulari. La sostituzione di queste cellule potrebbe rigenerare la parte di tessuto danneggiata; inoltre, la produzione standardizzata di grandi quantità di cellule euploidi umane, come i cardiomiociti e i neuroni, potrebbe fornire una fonte illimitata di cellule per verificare l’efficacia di nuovi farmaci, per controllarne la tossicità o per la terapia dei trapianti. In patologie genetiche la manipolazione del genoma è necessaria per correggere il difetto nelle c. s. e può avvalersi di nuovi approcci di gene editing, evitando l’utilizzo di vettori virali e i loro possibili effetti collaterali. CRISPR/Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats/Cas9, dove Cas9 è una nucleasi) e TALEN (Transcription Activator-Like Effector Nucleases) sono gli strumenti più innovativi a disposizione nella tecnica dell’editing genetico (fig. 2). Mentre TALEN utilizza una proteina che lega una porzione specifica di DNA, i CRISPR usano un ‘RNA guida’, molto più facile da generare. Con queste tecnologie, nelle c. s. è possibile tagliare il frammento di DNA contenente la mutazione e sostituirlo con quello corretto prima di un eventuale trapianto autologo.
Il trapianto di c. s. può apportare un beneficio al tessuto danneggiato attraverso due meccanismi: il differenziamento cellulare e il rilascio di mediatori paracrini. Il termine differenziamento indica la capacità delle c. s. di adottare le caratteristiche biologiche e fisiologiche di un tipo di cellula altamente differenziata. In alcuni tessuti i progenitori ematopoietici o mesenchimali possono però fondersi con le cellule del muscolo cardiaco senza apportare nessun beneficio. Le c. s. trapiantate possono inoltre rilasciare citochine e fattori di crescita in grado di favorire la sopravvivenza delle cellule danneggiate e stimolare il differenziamento delle c. s. residenti. È molto probabile che questi meccanismi non agiscano in modo separato ed esclusivo, ma che si manifestino sinergicamente per aumentare la rigenerazione del tessuto danneggiato.
Le cellule staminali nel Terzo millennio. – Negli ultimi dieci anni le c. s. sono state oggetto di intenso studio nei laboratori di ricerca in tutto il mondo e anche il motivo della nascita di piccole e medie imprese biotecnologiche (SME, Small and Medium Enterprises) orientate allo sviluppo di nuove tecnologie e focalizzate sulla ricerca applicata, tanto che in Europa le SME hanno creato l’85% dei nuovi posti di lavoro, rappresentando così delle realtà importanti anche per le economie nazionali.
La ricerca sulle c. s. è una disciplina giovane e pertanto in rapidissimo cambiamento, sia per quanto riguarda la direzione futura in vista delle nuove scoperte, sia per la tecnologia utilizzata in continua evoluzione. Le c. s. pluripotenti di Yamanaka sono oggi il cuore pulsante dell’attività di ricerca di centinaia di laboratori in tutto il mondo e anche per esse la sperimentazione clinica è solo agli inizi. Sono però pochissimi i casi di successo di terapie con c. s., comunque legate a scoperte di molti anni fa. Per es., c. s. adulte isolate da vasi sanguigni e denominate mesoangioblasti sono state studiate per le loro potenzialità miogeniche. Su questa base è stato effettuato uno studio clinico in Italia di fase I/II per cinque pazienti pediatrici affetti da distrofia muscolare di Duchenne, con risultati incoraggianti. Nel 2011 è terminato il primo studio clinico con progenitori neurali derivati da c. s. embrionali umane impiantate in pazienti affetti da paraplegia. Nessuno dei pazienti trattati ha mostrato gravi eventi avversi, ma non è stato riscontrato alcun miglioramento del midollo spinale e delle condizioni neurologiche. La società biotecnologica Ocata therapeutics, Inc. (Mass.) ha condotto studi volti a migliorare la visione dei pazienti affetti da distrofia maculare giovanile di Stargardt e da degenerazione maculare seni le. Negli occhi dei pazienti sono state iniettate cellule epiteliali pigmentate della retina derivate da c. s. embrionali umane. In Giappone nel 2014 una donna di 70 anni affetta da degenerazione maculare senile è stata la prima paziente a ricevere cellule epiteliali pigmentate retiniche derivate dalle proprie c. s. pluripotenti indotte. In Belgio e in Spagna è in corso uno studio clinico di fase I/II sugli effetti paracrini di c. s. cardiache su pazienti affetti da cardiomiopatia dilatativa. Questi esempi mostrano come le c. s. pluripotenti e quelle adulte stiano uscendo dai laboratori sperimentali per essere impiegate in studi clinici. La strada è ancora lunga ed è plausibile che molti di questi prodotti cellulari e protocolli terapeutici torneranno nei laboratori per essere ulteriormente studiati e potenziati.
Bibliografia: K.H. Campbell, J. McWhir, W.A. Ritchie et al., Sheep cloned by nuclear transfer from a cultured cell line, «Nature», 1996, 380, 6569, pp. 64-66; K. Takahashi, S. Yamanaka, Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors, «Cell», 2006, 126, 4, pp. 663-76; M. Sampaolesi, Le cellule staminali. Tra scienza, etica e usi terapeutici, Bologna 2011; E. Berardi, M. Pues, L. Thorrez et al., miRNAs in ESC differentiation, «American journal of physiology. Heart and circulatory physiology», 2012, 303, 8, pp. H931-39; J.B. Gurdon, The egg and the nucleus: a battle for supremacy (Nobel lecture), «Angewandte Chemie. International edition», 2013, 52, 52, pp. 13890-99; Handbook of stem cells, ed. R.P. Lanza, A. Atala, 2 voll., Amsterdam 20132; A. Sánchez Alvarado, S. Yamanaka, Rethinking differentiation: stem cells, regeneration, and plasticity, «Cell», 2014, 157, 1, pp. 110-19; S. Beck , B.-K. Lee, J. Kim, Multi-layered global gene regulation in mouse embryonic stem cells, «Cellular and molecular life sciences», 2015, 72, 2, pp. 199-216; M.A. Goodell, H. Nguyen, N. Shroyer, Somatic stem cell heterogeneity: diversity in the blood, skin and intestinal stem cell compartments, «Nature reviews. Molecular cell biology», 2015, 16, 5, pp. 299-309; M. Quattrocelli, M. Sampaolesi, The mesmirizing complexity of microRNAs for striated muscle tissue engineering, «Advanced drug delivery reviews», 2015, 88, pp. 37-52.
© Istituto della Enciclopedia Italiana - Riproduzione riservata