Citochine
Enciclopedia della Scienza e della Tecnica (2007)
Citochine
Le citochine sono mediatori polipeptidici, non antigene-specifici, che fungono da segnali di comunicazione fra le cellule del sistema immunitario e fra queste e diversi organi e tessuti; dunque citochine, fattori di crescita e ormoni polipeptidici sono un gruppo di proteine regolatorie, coinvolte nei circuiti di comunicazione extracellulare, e presentano tra loro similitudini ma anche caratteri specifici. Infatti, alcune proprietà di carattere generale distinguono le citochine dai fattori di crescita e dagli ormoni. I fattori di crescita non emopoietici tendono a essere prodotti in modo costitutivo e i loro bersagli principali sono formati da cellule non emopoietiche. Gli ormoni di crescita endocrini sono in genere prodotti da cellule specializzate o da tessuti specializzati. Al contrario, le citochine solitamente sono prodotte da una varietà di tipi cellulari o, quando la produzione è ristretta a cellule linfo-idi, come nel caso di interleuchina-2 (IL-2) e interferone-γ (IFN-γ), questa rappresenta soltanto una delle tante funzioni che caratterizzano la cellula produttrice.
Gli ormoni sono rilasciati in circolo e agiscono in siti distanti. La produzione di citochine invece è transitoria: in genere queste proteine agiscono a breve distanza e di regola non si ritrovano in quantità importanti in circolo in condizioni normali. Gli ormoni polipeptidici sono spesso limitati nella loro azione a un ristretto numero di bersagli cellulari, con eccezioni importanti quali l'insulina. Al contrario, molte citochine sono pleiotropiche, nel senso che agiscono su una grande varietà di cellule e di tessuti. Ancora, a differenza degli ormoni, citochine strutturalmente diverse, come è il caso di interleuchina-1 (IL-1) e del fattore di necrosi tumorale (TNF), hanno azioni che in larga misura si sovrappongono. Nessuna di queste caratteristiche distintive è assoluta. Per esempio, il Transforming growth factor-β (TGF-β) e il fattore di stimolazione delle colonie M (M-CSF) sono presenti in quantità cospicue in circolo in condizioni normali; ancora, IL-6 è prodotta in risposta a segnali infiammatori locali, ma agisce a distanza sul fegato contribuendo alla risposta di fase acuta. Dunque, i criteri sopra delineati definiscono i confini dell'universo delle citochine in modo non rigido e assoluto.
Le citochine possono essere classificate utilizzando criteri diversi, comprendenti caratteristiche di tipo strutturale, classe di recettori riconosciuti e loro caratteristiche funzionali. Una classificazione utile dal punto di vista operativo è quella di distinguere le citochine sulla base delle loro proprietà funzionali. La classificazione funzionale è una ipersemplificazione e deve essere considerata più uno strumento di orientamento che non un modo accurato di definire la funzione di queste molecole. Una classificazione funzionale delle citochine comprende: (a) le citochine emopoietiche (per es., i fattori di crescita dell'emopoiesi, o CSF); (b) le citochine infiammatorie primarie (per es., IL-1 e TNF); (c) le citochine antinfiammatorie o immunosoppressive (IL-10 e TGF-β); (d) le citochine infiammatorie secondarie (le chemochine); (e) le citochine dell'immunità specifica (per es., IL-2).
Se da una parte la scoperta recente della superfamiglia delle chemochine ha avuto un impatto trasversale in settori diversi della biologia che vanno dalla ricerca sul virus dell'HIV all'immunologia, dall'altra le scoperte sull'immunobiologia delle citochine quali IL-1 e TNF hanno portato allo sviluppo di strategie terapeutiche innovative per malattie quali l'artrite reumatoide e le malattie infiammatorie intestinali.
Interleuchina-1 (IL-1)
IL-1 costituisce il prototipo di una citochina infiammatoria. IL-1 è in realtà costituita da due molecole distinte, codificate da geni distinti, dette IL-1α e IL-1β, che hanno attività simili e interagiscono con gli stessi recettori, benché dal punto di vista strutturale abbiano una omologia di sequenza solo di circa il 20%. IL-1 è in realtà un sistema complesso costituito da due molecole agoniste, un antagonista di cui esistono diverse isoforme e un complesso sistema recettoriale. IL-1α e IL-1β vengono sintetizzati come propeptidi di circa 33 kDa di peso molecolare. I propeptidi vengono processati all'interno della cellula a una forma matura di 17 kDa di peso molecolare, che viene secreta attraverso meccanismi non convenzionali, dato che IL-1β non possiede una sequenza segnale. Il propeptide di IL-1β viene processato da un enzima detto 'caspasi-1' o IL-1 converting enzyme (ICE). L'enzima di conversione di IL-1 è stato il primo membro identificato della famiglia enzimatica delle caspasi che giocano un ruolo cruciale nella regolazione della apoptosi.
I principali produttori di IL-1 sono i monociti-macrofagi, anche se questa citochina è prodotta da una varietà di tipi cellulari. Una varietà di stimoli proinfiammatori induce la produzione di IL-1, ma particolarmente importanti sono i prodotti microbici ligandi dei recettori della famiglia Toll e delle citochine primarie. Infatti IL-1 è indotta da IL-1 stessa e da TNF, innescando così un meccanismo di amplificazione della risposta infiammatoria. La famiglia di IL-1 comprende oltre alle due molecole agoniste, IL-1α e IL-1β, un antagonista recettoriale (IL-1ra). IL-1ra è prodotto dalle stesse cellule che producono IL-1 ed è indotto in generale dagli stessi segnali, anche se citochine antinfiammatorie inducono la produzione preferenziale di IL-1ra. IL-1ra è un antagonista nel senso che lega il recettore, non dà alcuna risposta biologica e impedisce inoltre alle molecole agoniste di interagire con il recettore.
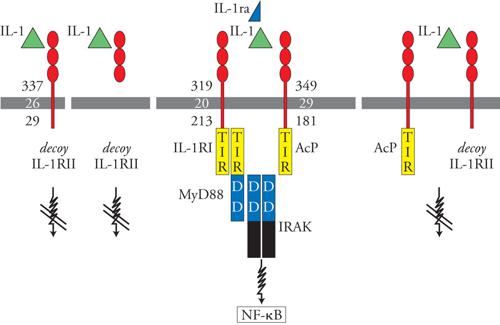
IL-1 interagisce con un recettore costituito da due catene, IL-1RI e catena accessoria (AcP). L'antagonista recettoriale interagisce solo con la catena IL-1RI, impedendo così la formazione di un complesso recettoriale attivo da parte delle molecole con attività agonista. Esiste un secondo recettore di IL-1, detto IL-1RII o decoy receptor, che ha caratteristiche peculiari. Infatti, IL-1RII in forma legata alla membrana o libera nei liquidi biologici lega IL-1 ma non dà luogo ad alcuna trasduzione del segnale. Agisce come una sorta di trappola molecolare che lega le molecole con attività agonista e impedisce loro di interagire con i componenti recettoriali che attivano la risposta cellulare. Il recettore decoy forma anche un complesso recettoriale con agonista e catena accessoria (AcP), che non trasduce alcun segnale. In questo modo si comporta da dominante negativo, sottraendo la catena accessoria che è essenziale per la formazione di un complesso recettoriale che trasduca segnali. Esistono dunque due circuiti di regolazione negativa intrinseci al sistema IL-1. Il sistema IL-1 infatti è regolato negativamente dall'antagonista recettoriale di IL-1 (IL-1ra) e da un falso recettore (decoy receptor) che funziona da trappola molecolare per l'agonista. La complessità dei circuiti di regolazione negativa sottolinea l'importanza di questa molecola, che è potenzialmente devastante per l'integrità dell'organismo (fig. 3). A valle del complesso recettoriale che segnala, IL-1 attiva una cascata di trasduzione del segnale che è centrata sull'adattatore MyD88. Questa cascata è analoga a quella attivata dai recettori della famiglia Toll-like receptor ed è innescata grazie alla presenza di un dominio TIR. Risultato finale dell'attivazione cellulare da parte di IL-1 è l'attivazione di fattori di trascrizione, quali NFκB e AP-1. IL-1 agisce praticamente su tutte le cellule e i tessuti dell'organismo ed è sufficiente un impegno di un numero limitatissimo di recettori, forse uno per cellula, per attivare la risposta cellulare. Molti degli effetti di IL-1 sono indiretti, nel senso che l'effetto finale dipende dalla induzione di mediatori secondari. Fra i mediatori secondari, particolarmente importanti sono IL-6 e i fattori di crescita emopoietici (GM-CSF e M-CSF). IL-1 agisce innanzitutto sulle cellule emopoietiche (precursori emopoietici, linfociti T e B). Gli effetti sono in genere di stimolazione della proliferazione e del differenziamento e sono in generale mediati dalla produzione di fattori di crescita e da IL-6.
Un secondo bersaglio importante dell'azione di IL-1 è costituito dal sistema nervoso centrale. IL-1 infatti è stata inizialmente identificata anche come un potente pirogeno endogeno. L'effetto pirogenico di IL-1 è indiretto, nel senso che IL-1 induce a livello dei centri ipotalamici la produzione di IL-6 e la produzione di prostaglandine, che costituiscono i mediatori ultimi dell'effetto pirogenico. Inoltre IL-1 a livello del sistema nervoso centrale induce anoressia e astenia, componenti evidenti della risposta infiammatoria sistemica. Infine, IL-1 agisce sui centri ipotalamici inducendo la produzione di releasing factor inducendo a livello ipotalamico la produzione di ACTH. ACTH funziona a livello surrenalico inducendo la produzione di ormoni glucocorticoidi. Gli ormoni glucocorticoidi hanno effetti complessi, fra i quali la capacità di spegnere la risposta infiammatoria. Infatti, gli ormoni glucocorticoidi inibiscono la produzione delle citochine infiammatorie quali IL-1 e aumentano la produzione di molecole antinfiammatorie quali il recettore decoy di IL-1. L'attivazione quindi dell'asse ipotalamo- ipofisi-surrene costituisce un'ansa di feedback negativo dell'attività proinfiammatoria delle citochine primarie dell'infiammazione.
Uno dei bersagli principali dell'attività di IL-1 è costituito dalle cellule dell'albero vascolare. IL-1 induce infatti a livello dell'endotelio vascolare la produzione di chemochine e di molecole di adesione, amplificando il reclutamento di cellule infiammatorie a livello locale. Inoltre, IL-1 induce l'espressione di enzimi che portano alla sintesi di prostaciclina (PGI2) e di NO, molecole con attività vasodilatatoria. Infine, IL-1 modifica profondamente le proprietà anticoagulanti dell'endotelio vascolare. Infatti in condizioni basali, l'endotelio vascolare è caratterizzato da proprietà anticoagulanti, costituendo una superficie non trombogenica. IL-1 modifica profondamente questa situazione. Innanzitutto IL-1 induce la produzione di attività procoagulante o tissue factor, che attiva la cascata coagulativa. Ancora, IL-1 inibisce l'asse anticoagulante costituito dalla proteina C e dalla trombomodulina. Insomma, a livello dell'endotelio vascolare, IL-1 attiva un programma genetico proinfiammatorio e protrombotico.
Le cellule del tessuto osseo, cartilagineo, della sinovia e dei tessuti connettivi in generale costituiscono un bersaglio importante dell'azione di IL-1. In queste cellule, IL-1 è in grado di indurre la produzione di proteasi e di prostaglandine, di molecole cioè che causano dissoluzione e danno del tessuto e fenomeni quali il riassorbimento osseo osservato in molte condizioni patologiche. A livello epatico, IL-1 induce la produzione di proteine di fase acuta. L'induzione di proteine di fase acuta è in larga misura indiretta, nel senso che il mediatore ultimo responsabile di questo effetto è IL-6. Infine, a livello cardiaco, IL-1 e TNF in particolar modo, inibiscono direttamente la contrattilità cardiaca e, a livello del muscolo scheletrico, favoriscono il catabolismo proteico.
Il fattore di necrosi tumorale (TNF)
TNF deve il suo nome all'attività necrotizzante esplicata nei confronti di alcuni tumori sperimentali. Si tratta però di un termine fuorviante, nel senso che l'effetto antitumorale non costituisce la principale o importante attività biologica di TNF che, similmente a IL-1, è una citochina primaria fondamentale nelle risposte infiammatorie. Come per IL-1, anche per TNF esistono due isoforme, il TNF-α e il TNF-β o linfotossina. Quest'ultima è prodotta principalmente da cellule linfoidi. TNF-α, per brevità TNF, è un mediatore centrale delle risposte infiammatorie che condivide buona parte dei suoi effetti biologici con IL-1. TNF è sintetizzato come un precursore di 26 kDa ed è una proteina transmembrana di tipo II, con l'N-terminale, cioè, all'interno della membrana plasmatica. La forma di membrana di TNF viene processata da una metalloproteasi detta TNF-α-converting enzyme (TACE) che dà luogo alla forma matura presente nei liquidi biologici di 17 kDa. Sia la forma di membrana di TNF che la forma solubile sono capaci di interagire con il recettore, quindi di attivare risposte biologiche. Come nel caso di IL-1 le sorgenti principali di TNF sono i fagociti mononucleati, anche se altri tipi cellulari sono in grado di produrre questa citochina.
TNF interagisce con due tipi di recettori, detti di 'tipo I', o 'p55', e recettore di 'tipo II', o 'p75'. TNF è un omotrimero e interagendo con il recettore causa la multimerizzazione delle catene recettoriali. La formazione di omotrimeri recettoriali attiva la via di trasduzione del segnale. In maniera un po' schematica si può affermare che il recettore di tipo I è un recettore di morte, che attiva cioè un programma di morte apoptotica centrato sull'attivazione di una cascata di enzimi proteolitici detti 'caspasi'. Il recettore di tipo II è invece un recettore che attiva funzionalmente la cellula e anzi alcuni dei geni indotti dal recettore di tipo II hanno la funzione di inibire la morte cellulare attivata dal recettore p55. La cascata di trasduzione del segnale attivata da p75 e in qualche misura da p55 porta all'attivazione di NF-κB e quindi all'induzione di un programma genetico proinfiammatorio. Il programma proinfiammatorio attivato da TNF è in larga misura sovrapponibile a quello di IL-1. Fanno eccezione gli effetti sui precursori emopoietici, dove TNF ha funzione inibitoria. L'inibizione dei precursori emopoietici è probabilmente responsabile degli effetti sulle cellule circolanti associati a patologie croniche con iperproduzione di TNF, quali per esempio l'anemia associata a patologie croniche.
Le chemochine
Gli stimoli chemiotattici svolgono un ruolo cruciale nel processo di reclutamento leucocitario. Questi stimoli non sono solo importanti per direzionare la migrazione dei leucociti attraverso la barriera endoteliale verso il sito infiammatorio, ma svolgono anche un ruolo cruciale nell'aumentare la loro adesività alla parete vascolare. Il termine chemochina (dall'inglese chemokine, forma contratta di chemotactic cytokine) identifica una superfamiglia di proteine dotate di attività chemiotattica. Le chemochine costituiscono una famiglia che comprende 47 molecole classificate nell'uomo che condividono alcune caratteristiche strutturali. Le chemochine sono proteine basiche di dimensioni relativamente piccole (60÷80 amminoacidi) con massa molecolare compresa tra 8 e 10 kDa e caratterizzate dalla presenza di quattro cisteine che danno origine a due ponti disolfuro, precisamente tra la prima e la terza, e tra la seconda e la quarta (fig. 4).
Questo motivo strutturale determina una struttura tridimensionale cruciale per l'interazione con i recettori. La posizione relativa delle prime due cisteine consente di identificare quattro sottofamiglie. Nella prima di esse il tandem cisteinico è interrotto da un terzo amminoacido, diverso da caso a caso, per cui si parla di Cys-X-Cys (o CXC) o di chemochine α. La seconda famiglia è invece caratterizzata da una coppia di residui cisteinici contigui e viene identificata con il nome di Cys-Cys (o CC) o chemochine β. Due chemochine identificano due ipotetiche ulteriori famiglie: la prima, linfotactina, è una proteina che possiede solo due delle quattro cisteine (la seconda e la terza) e viene identificata come famiglia delle C chemochine o γ, mentre fractalchina è caratterizzata da tre amminoacidi che separano le due cisteine (CX3C, o chemochine δ). I geni delle chemochine α sono in massima parte localizzati sul cromosoma 2 dell'uomo, mentre le chemochine β sono localizzate sul cromosoma 17.
Le proteine appartenenti alla famiglia delle chemochine vengono attualmente identificate tramite la nuova nomenclatura che utilizza il prefisso CXCL, CCL, CL o CX3CL e un numero progressivo. Le chemochine α sono attive sui polimorfonucleati neutrofili (quelle che possiedono il motivo ELR, cioè gli amminoacidi Glu-Leu-Ala) e sui linfociti T e B. Le chemochine β (CCL) sono attive sui leucociti mononucleati (monociti, linfociti, cellule NK e sugli eosinofili e basofili). Linfotactina e fractalchina sono attive sui linfociti T e sulle cellule NK. CXCL8 (IL-8) rappresenta un segnale chemiotattico importante per i neutrofili. CCL2 (MCP-1) svolge un ruolo rilevante nel reclutamento dei monociti, mentre CCL11 (eotassina) è attiva sui granulociti eosinofili.
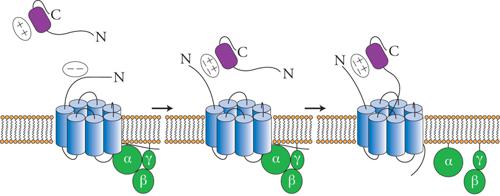
Le chemochine agiscono attraverso recettori di membrana che appartengono alla famiglia dei recettori di tipo rodopsinico, caratterizzati da sette domini transmembrana (fig. 5). Questi recettori sono associati a proteine G eterotrimeriche, la cui attivazione causa l'aumento della concentrazione di calcio intracellulare e del metabolismo dei fosfolipidi di membrana a opera delle fosfolipasi C, D e A2. Attualmente sono noti dieci recettori per le chemochine α identificati come CCR-1-CCR-10, e cinque per quelle β (CXCR-1-CXCR-5). I recettori per le chemochine generalmente legano più di una chemochina, purché esse appartengano alla stessa famiglia, e spesso una chemochina può legare più di un recettore. Le chemochine sono dotate essenzialmente di azione chemiotattica, tuttavia in presenza di agenti primari dell'infiammazione, quali TNF-α o IL-1, le chemochine sono anche in grado di indurre l'attivazione di altre risposte biologiche, quali la degranulazione e la produzione di intermedi reattivi dell'ossigeno. Inoltre, le chemochine sono anche in grado di attivare la trascrizione di geni funzionalmente coinvolti nel processo di migrazione, quali recettori per chemochine, proteasi utilizzate dal leucocita per degradare la matrice extracellulare e chemochine stesse. Queste funzioni svolgono un ruolo rilevante nell'amplificare la risposta infiammatoria.
Bibliografia
Gerard, Rollins 2001: Gerard, Craig - Rollins, Barrett J., Chemokines and disease, "Nature immunology", 2, 2001, pp. 108-115.
Gordon 2003: Gordon, Siamon, Alternative activation of macrophages, "Nature reviews. Immunology", 3, 23, 2003.
Mantovani 1999: Mantovani, Alberto, The chemokine system: redundancy for robust outputs, "Immunology today", 20, 1999, pp. 254-257.
Mantovani 2000: Mantovani, Alberto - Dinarello, Charles A. - Ghezzi, Pietro, Pharmacology of cytokines, London, Oxford University Press, 2000.
Mantovani 2001: Mantovani, Alberto e altri, Decoy receptors: a strategy to regulate inflammatory cytokines and chemokines, "Trends in immunology", 22, 2001, pp. 328-336.
Mantovani 2002: Mantovani, Alberto e altri, Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes, "Trends in immunology", 23, 2002, pp. 549-555.
Medzhitov 2001: Medzhitov, Ruslan, Toll-like receptors and innate immunity, "Nature reviews. Immunology", 1, 2001, pp. 135-145.