Glucosio
Enciclopedia on line
(o glicosio) Il monosaccaride più diffuso in natura. È chiamato anche destrosio; un tempo era noto anche con i nomi di zucchero d’uva o d’amido.
Generalità
Il g. si trova allo stato libero nella frutta dolce, nel miele, nel nettare dei fiori e in piccole quantità negli organismi animali. Sotto forma combinata si trova in molti glicosidi; allo stato di polimero costituisce l’amido, la cellulosa, il glicogeno ecc. Chimicamente è un aldoesoso, C6H12O6, che cristallizza, sia anidro sia idrato (con una molecola d’acqua), formando cristalli trasparenti, solubili, di sapore dolce ma meno intenso di quello dello zucchero comune. Le sue soluzioni hanno potere rotatorio specifico destrogiro di 52,7°, riducono il reattivo di Fehling, le soluzioni ammoniacali di nitrato d’argento (con separazione di argento metallico), il reattivo di Nylander (proprietà tutte sfruttate anche per una determinazione quantitativa del g.).
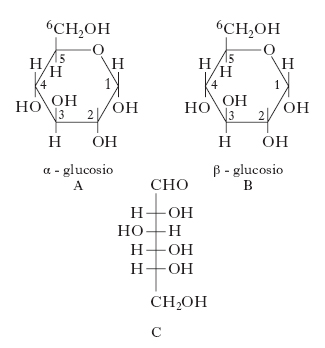
Il g. è caratterizzato da una struttura ciclica costituita da un anello piranico ed esiste in due forme anomere: α-g. e β-g. (A e B in fig.). La prima fonde a 146 °C e ha potere rotatorio specifico uguale a +112°; la seconda fonde a 150 °C con potere rotatorio specifico uguale a +19°. In soluzione acquosa le due forme si convertono parzialmente l’una nell’altra (mutarotazione) in modo tale che il potere rotatorio diventa in entrambi i casi uguale a +52,7°. La conversione avviene attraverso l’apertura dell’anello in quanto, in soluzione acquosa, le due forme cicliche sono in equilibrio con quella a catena aperta (C in fig.) che è presente in ragione dello 0,5% circa. La struttura ciclica spiega il fatto che il g. non dà alcune delle reazioni tipiche delle aldeidi; la facilità con cui il g. subisce idrolisi in soluzione con conseguente apertura dalla struttura chiusa è invece dovuta alla natura emiacetalica dell’anello. Alla piccola percentuale di struttura aperta presente in soluzione sono probabilmente dovute alcune reazioni del g. (formazione di osazoni, riduzione) caratteristiche del gruppo aldeidico; la concentrazione della forma lineare è tuttavia insufficiente per dar luogo ad altre reazioni tipiche del gruppo (reazione di Schiff, addizione di bisolfito) caratterizzate da maggior reversibilità.
Preparazione e impiego
Il g. si prepara per idrolisi di una soluzione acquosa concentrata di amido, addizionata di 0,5-1% di acido cloridrico o solforico e mantenuta per circa un’ora in autoclave alla temperatura di circa 140 °C. Dopo neutralizzazione dell’acido, si filtra e si evapora la soluzione. Si può produrre l’idrolisi dell’amido, anziché con acidi, con enzimi. Data la difficoltà di far cristallizzare il g., esso è posto in commercio prevalentemente come sciroppo, denso, incolore, trasparente, costituito oltre che da g. anche da destrine (amido solo parzialmente idrolizzato). Per avere g. cristallizzato (monoidrato) occorre evitare la presenza di destrine ed evaporare a pressione ridotta fino a ottenere uno sciroppo col 75% circa di sostanza secca. Il g. anidro si ottiene sciogliendo il monoidrato in acqua e facendo cristallizzare a temperatura più o meno alta in apparecchi sotto vuoto.
Il g. si usa sia come dolcificante, come correttivo e come eccipiente, nella concia del tabacco, nella preparazione di adesivi, nell’apprettatura dei tessuti, come addensante in stamperia, in tintoria, nella concia delle pelli.
G. e metabolismo
Il g. è uno dei substrati principali del metabolismo energetico cellulare. Infatti, l’ossidazione completa di 1 mole di g. nei cicli metabolici della glicolisi, degli acidi tricarbossilici e della fosforilazione ossidativa genera 36 moli di ATP, composto che permette lo svolgimento di moltissime reazioni che richiedono un dispendio di energia. Il valore alimentare del g. è accresciuto dalla peculiarità di non richiedere alcuna elaborazione digestiva e di poter essere somministrato a individui con problemi gastroenterici, nonché, opportunamente diluito, per via rettale o parenterale a scopo nutritivo o diuretico o per combattere crisi ipoglicemiche o per correggere squilibri osmotici.
In fisiologia, il g. ha grande importanza anche perché rappresenta la forma in cui i glicidi si trasformano per essere utilizzati dall’organismo per formare il glicogeno del fegato, il lattosio del latte, il ribosio dei nucleotidi ecc. Negli organismi inferiori il g. ha parte fondamentale in molti processi biochimici, come la respirazione (vegetali), la fermentazione alcolica (batteri, lieviti, muffe) e simili.
Composti
Il g. (o glucoso)-fosfato (o g.-monofosfato) è un composto derivante dalla combinazione di g. con una molecola di acido fosforico; questa può fissarsi in corrispondenza dell’atomo di carbonio in posizione 1 o 6 del g. (si ha rispettivamente il g.-1-fosfato, o estere di Cori, e il g.-6-fosfato o estere di Robinson). La formazione di g.-6-fosfato avviene nell’organismo in seguito all’attività dell’esochinasi e rappresenta la prima trasformazione metabolica del g. (➔ glicolisi; fosfoglucomutasi).
Il g.-6-fosfato-deidrogenasi (G6PD) è un enzima che catalizza l’ossidazione del g.-6-fosfato a 6-fosfogluconato. Tale reazione costituisce il primo stadio della via ossidativa dei pentosi fosfati. La g.-6-fosfato-deidrogenasi si ritrova in tutti i tessuti animali e nei microrganismi. Ne sono ricchi gli eritrociti, i surreni, la milza, il timo e i linfonodi. La sua determinazione ha interesse in chimica clinica per la diagnosi della carenza ereditaria di g.-6-fosfato-deidrogenasi che provoca una grave forma di anemia emolitica nota come favismo (➔ fava).
© Istituto della Enciclopedia Italiana - Riproduzione riservata