Urea
Enciclopedia on line
urea Composto chimico, H2NCO−NH2, che si può considerare come l’ammide dell’acido carbammico o la diammide dell’acido carbonico.
Caratteri generali
L’u. rappresenta una delle forme a bassa tossicità in cui gli organismi viventi eliminano l’ammoniaca (anche sotto forma di ioni ammonio NH+4) derivante dalla deamminazione metabolica degli amminoacidi. È stato il primo composto organico ottenuto per sintesi (nel 1828 da F. Wöhler). Cristalli incolori che fondono a 133 °C, solubili in acqua, leggermente igroscopici; le sue soluzioni neutre si idrolizzano solo lentamente, ma a caldo; in presenza di acidi o di basi o di enzimi (ureasi), l’idrolisi procede più rapidamente. L’u. forma complessi cristallini con composti inorganici (cloruri di sodio, di ammonio, sali di rame, di zinco ecc.) e organici (idrocarburi alifatici a catena lineare). Reagisce con la formaldeide dando le resine ureiche, con l’acido malonico e con i suoi esteri formando l’acido barbiturico, con l’alcol etilico a caldo e sotto pressione dando origine all’uretano. Nitrato di u. Sale dell’u. che si forma mescolando soluzioni acquose di u. e di acido nitrico; ha formula H2NCONH2•HNO3; cristalli bianchi, solubili in acqua calda. Ureide Composto chimico ottenuto per sostituzione di un atomo d’idrogeno dell’u. con un radicale di un acido organico (radicale acile), di formula generale H2NCONH−COR, dove R è un radicale alchilico. Le ureidi comprendono diversi composti di interesse terapeutico per le loro proprietà sedative.
Ciclo dell’urea
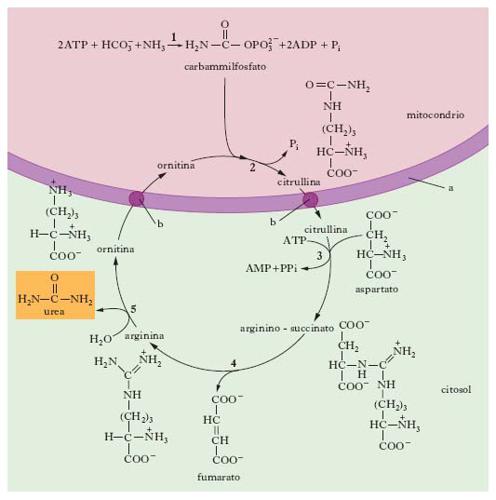
Gli organismi ureotelici (Mammiferi compreso l’Uomo, Anfibi, Rettili Chelonidi, Pesci Elasmobranchi e Teleostei) si proteggono dall’azione tossica dell’ammoniaca trasformandola, nel fegato, in u. (ureotelismo). L’u. viene sintetizzata enzimaticamente all’interno del fegato, e poi secreta nel sangue e sequestrata dai reni per essere escreta nell’urina. Il ciclo dell’u. è stato il primo ciclo metabolico a essere chiarito nel suo schema generale (v. fig.), grazie al lavoro dei biochimici H.A. Krebs e K. Henseleit, nel 1932. La reazione complessiva del ciclo dell’u. è:
NH3 + HCO−3 + aspartato + 3ATP → urea + fumarato + 2ADP + 2Pi+ AMP + PPi,
dove Pi e PPi indicano, rispettivamente, fosforo inorganico e pirofosfato. Nel ciclo dell’u. sono coinvolte 5 reazioni enzimatiche, due delle quali sono mitocondriali e tre citosoliche. La prima reazione, che si può dire tecnicamente non appartenente al ciclo, avviene nel mitocondrio e consiste nella condensazione tra ammoniaca (o NH+4) e acido carbonico (derivante dalla CO2) a opera dell’enzima carbammilfosfato sintetasi. Questa reazione, che provoca il consumo di 2 ATP e la formazione di carbammilfosfato, è irreversibile, e costituisce la tappa limitante dell’intero ciclo. Nella seconda reazione mitocondriale, il gruppo carbammilico del carbammilfosfato viene trasferito, per azione dell’enzima ornitina transcarbammilasi, su una molecola di ornitina, formando citrullina. Trasportatori specifici presenti sulla membrana mitocondriale trasferiscono la citrullina dall’ambiente mitocondriale a quello citosolico. Qui ha luogo la terza reazione che, grazie all’enzima arginino succinato sintetasi, porta alla condensazione di citrullina con aspartato; quest’ultimo rappresenta il composto chimico donatore del secondo atomo di azoto presente nella molecola di u. (il primo deriva dall’ammoniaca); in questa reazione viene consumata la terza molecola di ATP. Successivamente, nella quarta reazione, catalizzata dall’enzima arginino succinasi, il complesso arginino-succinato è convertito in fumarato, che rappresenta il composto di collegamento diretto con il ciclo dell’acido citrico. Quest’ultima, nella quinta e ultima reazione, è idrolizzata dall’enzima arginasi, per formare ornitina (che è ritrasportata nel mitocondrio e rientra nel ciclo) e urea.
Data la sua grande diffusibilità, la concentrazione di u. è pressoché eguale, nei tessuti e nel sangue. L’u., presente in piccola concentrazione anche nella bile e nel latte, viene rapidamente allontanata dall’organismo con le urine, che la contengono in elevata concentrazione (l’uomo normalmente in 24 ore ne elimina 15-35 g) perché per questa sostanza, a eccezione dei casi di gravi lesioni tubulari tossiche, non esiste riassorbimento tubulare. In relazione alla sua solubilità, l’u. si può considerare atossica, ma quando per cause patologiche si accumula nel sangue e nei tessuti è causa di uremia. U.-clearance Prova di funzionalità renale che mira a valutare l’attitudine del rene a eliminare l’u. contenuta nel sangue. È stata la prima prova di clearance di largo impiego, ormai raramente utilizzata.
L’enzima ureasi (peso molecolare 483.000), appartenente alla classe delle idrolasi, idrolizza l’u. in ammoniaca e anidride carbonica. Quella di fagiolo è stata il primo enzima a essere ottenuto in forma cristallina grazie agli studi di J. Summer, nel 1926. Abbonda nelle piante (in particolare, nella soia e nelle fave). Inoltre, è presente nei funghi e in molti batteri, detti perciò ureolitici, come l’urobatterio Micrococcus ureae, responsabile del forte odore ammoniacale delle urine putrefatte. Nel regno animale l’ureasi è stata rilevata solo in alcuni crostacei e invertebrati marini; per questo motivo, se somministrata ad altri animali, è altamente nociva a causa della tossicità derivante dalla liberazione di ammoniaca.
Sintesi industriale
La sintesi industriale dell’u. avviene a partire da ammoniaca liquida e anidride carbonica compressa. La reazione procede attraverso la formazione (esotermica) di un composto intermedio, il carbammato d’ammonio (2NH3+CO2→H2NCO2NH4), il quale per successiva decomposizione (leggermente endotermica) dà u. e una molecola d’acqua (H2NCO2NH4⇄(NH2)2CO+H2O). La prima reazione avviene con resa quasi totale in un reattore che opera a temperature di 160-200 °C e a pressioni di 150-200 bar. Il carbammato così formatosi passa poi in un reattore decompositore, dove si ha la formazione di u. e dove il carbammato residuo si dissocia in ammoniaca e anidride carbonica. Nelle condizioni generalmente adottate nel reattore decompositore si converte in u. il 50-55% del carbammato; solo in condizioni particolari la conversione in u. può salire al 70-80%. Si ha in ogni caso una percentuale piuttosto elevata di ammoniaca e anidride carbonica che non si trasformano in u. e che devono essere riportate in ciclo. Questi due gas devono essere ricompressi alla pressione di esercizio prima di essere immessi nuovamente nel primo reattore; tale ricompressione, tuttavia, non si può fare direttamente perché essi, trovandosi mescolati, tenderebbero a dare incrostazioni di carbammato nelle tubazioni. Una possibile soluzione consiste nel separare i due gas e poi comprimerli, ma tale scelta comporta complessità d’impianto e costi di gestione elevati. È preferibile decomporre il carbammato senza abbassare la pressione totale del sistema, ma riducendo la pressione parziale del carbammato e aumentando quella di uno dei gas (anidride carbonica o ammoniaca). In questo modo, la miscela di u. e carbammato che si forma nel reattore decompositore viene mantenuta nelle condizioni di reazione, mentre si fa circolare una corrente di ammoniaca o di anidride carbonica che favorisce la decomposizione del carbammato. La miscela di anidride carbonica, ammoniaca e vapor acqueo, che esce calda dal reattore decompositore, viene fatta condensare sotto forma di una soluzione acquosa di carbammato, che, trovandosi alla stessa pressione che regna nel sistema di reazione, può rientrare in ciclo.
L’u. è il composto organico di sintesi più largamente prodotto nel mondo. Circa il 90% dell’u. prodotta viene usata come fertilizzante, sia sotto forma solida sia in soluzione acquosa insieme con altri componenti (ammoniaca, fosfato e nitrato ammonico ecc.). Il prodotto solido viene commercializzato quasi esclusivamente sotto forma di sferette bianche di 1,5-2,5 mm di diametro, essendo questa la forma più idonea per la conservazione in magazzino o nei sacchi, e che possiede la massima fluidità per la distribuzione con macchine automatiche sul terreno. A differenza degli altri fertilizzanti azotati, l’u. si dissolve nell’ambiente colloidale del terreno e ciò ne diminuisce le perdite per dilavamento in caso di pioggia: in seguito intervengono i processi enzimatici di trasformazione a carbonato ammonico, che viene poi convertito gradualmente in nitrato ammoniaco; il processo completo richiede circa 3-4 settimane a seconda delle condizioni climatiche e della composizione del terreno. Circa il 2-4% dell’u. viene usato come componente nei mangimi, il rimanente è utilizzato per scopi industriali, prevalentemente per resine ureiche, impiegate per la realizzazione di elettrodomestici, oggetti di arredamento, impianti igienici e come leganti nell’industria del legno, e anche per molte sintesi organiche (barbiturici, caffeina, idrazina, acido solfammico, guanidina ecc.). La proprietà dell’u. di formare complessi cristallini (addotti) con gli idrocarburi alifatici a catena lineare si utilizza nell’industria petrolifera per il frazionamento di miscele di paraffine a struttura lineare e ramificata.
Produzione
La produzione mondiale di u. si presenta, dagli anni 1980, in crescita costante, e ha raggiunto nel 2008 le 146.000 t. Diminuita nei paesi a industrializzazione avanzata, la produzione si è spostata verso luoghi a larga disponibilità di materia prima (gas naturale), dove è possibile ottenere notevoli riduzioni dei costi di produzione. Tra queste aree, le maggiori sono quella gravitante sul Mar Nero, che rifornisce l’Europa e l’America latina, e il Golfo Persico, che rifornisce il Nord America, l’Asia e l’Oceania. In Asia, l’elevata capacità produttiva della Cina e, soprattutto, dell’India ha consentito loro di diminuire fortemente le quantità importate.
© Istituto della Enciclopedia Italiana - Riproduzione riservata