Virus
Enciclopedia on line
Biologia e medicina
Gruppo di organismi di natura non cellulare e di dimensioni submicroscopiche costituiti da un acido nucleico rivestito da un involucro proteico (capside) incapaci di una sintesi proteica autonoma e perciò caratterizzati dalla vita parassitaria endocellulare obbligata; sono agenti eziologici di numerose malattie di animali, piante e batteri.
Generalità
I v. sono costituiti da un solo tipo di acido nucleico (DNA o RNA) racchiuso in un contenitore di natura proteica; si riproducono traducendo le informazioni genetiche solo quando il loro genoma viene introdotto in una cellula; sono incapaci di aumentare di dimensioni o di subire scissione binaria; mancano di ribosomi e di sistemi enzimatici deputati alla produzione di energia; sono sprovvisti di capacità biosintetiche autonome e si servono dell’apparato biosintetico della cellula ospite per la loro replicazione.
Struttura
Una particella virale completa si chiama virione e la sua funzione è quella di introdurre il proprio acido nucleico all’interno di una cellula ospite, affinché esso possa essere espresso dall’apparato biosintetico della stessa. L’acido nucleico contiene l’informazione genetica necessaria per codificare tutte le funzioni replicative del v., compresa la programmazione della cellula ospite per l’espletamento delle funzioni necessarie per la moltiplicazione virale. Il rivestimento proteico ha la doppia funzione di proteggere l’acido nucleico dalla degradazione degli agenti denaturanti presenti nell’ambiente extracellulare e di consentire l’adesione del virione su specifici recettori della membrana citoplasmatica della cellula ospite. Le proteine del rivestimento sono codificate dal genoma virale, la cui ridotta lunghezza impone una limitazione al numero di proteine destinate a una data funzione. Per questo motivo, in genere, il rivestimento è costituito da unità ripetitive di una o poche proteine, che si combinano tra loro a formare una struttura continua. Questa combinazione può seguire due schemi fondamentali: una distribuzione elicoidale intorno all’acido nucleico (simmetria elicoidale) o la costituzione di una sorta di guscio icosaedrico (simmetria cubica), che si chiama capside e racchiude l’acido nucleico e le proteine a esso associate, le nucleoproteine. Le nucleoproteine insieme al genoma formano il cosiddetto nucleocapside.
Oltre a questo rivestimento molti v., indipendentemente dal tipo di simmetria, ne possiedono un secondo più esterno che è costituito da proteine virali e lipidi cellulari; tale rivestimento più esterno si chiama pericapside: in particolare si definiscono rivestiti i v. dotati di pericapside e nudi quelli che ne sono privi. A eccezione dei Filovirus, Poxvirus e Rhabdovirus, tutti i v. patogeni per l’Uomo hanno una morfologia grossolanamente sferica. Infatti, nei v. a simmetria icosaedrica le subunità proteiche del capside, dette capsomeri, si combinano a formare solidi regolari che al microscopio elettronico appaiono come sfere. Nei v. a simmetria elicoidale le subunità proteiche, denominate protomeri, si dispongono lungo l’asse dell’acido nucleico formando strutture tubulari, che però nei v. animali vengono racchiuse nel rivestimento pericapsidico il quale conferisce loro una forma globosa. Le dimensioni che di regola sono fisse nei vari tipi di v. nudi e, al contrario, piuttosto variabili in quelli rivestiti, oscillano da circa 20 a 200-250 nm.
Il genoma può essere costituito da DNA o da RNA e può essere monocatenario o bicatenario, lineare oppure circolare, e costituito da un’unica molecola o da vari segmenti; in quest’ultimo caso si parla di genoma segmentato. Nei v. con RNA monocatenario, questo può essere orientato come un RNA messaggero (RNAm a polarità positiva) o in modo complementare all’RNAm (antisenso o a polarità negativa). A seconda del tipo di genoma la replicazione segue particolari meccanismi di replicazione.
Esistono anche entità biologiche ancora più piccole dei v., dette viroidi, responsabili di alcune malattie delle piante e probabilmente anche di alcune malattie degli animali e dell’Uomo. I viroidi sono costituiti esclusivamente da piccole molecole circolari o lineari di RNA. Altri agenti infettanti similvirali sono ancora più elementari, in quanto costituiti da piccole proteine autoreplicanti, dette prioni, non associate ad alcun acido nucleico e responsabili di gravi malattie neurologiche degenerative negli animali e nell’Uomo.
Classificazione
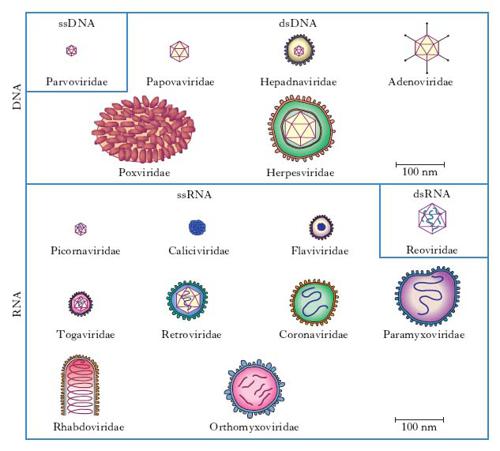
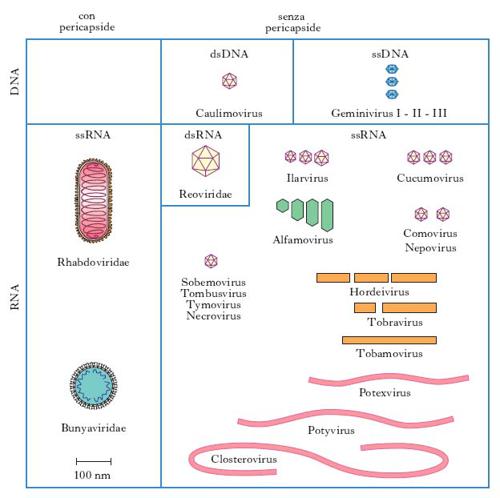
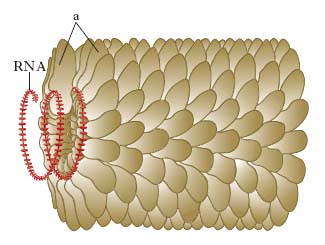
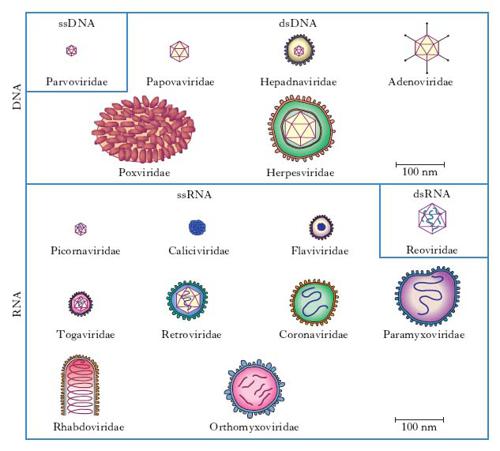
In base alle loro caratteristiche fisiche, cliniche, morfologiche e biologiche i v. sono suddivisi in famiglie (con suffisso -viridae), generi (con suffisso -virus) e specie. Ulteriori suddivisioni (sottospecie, tipi, ceppi ecc.) sono stabilite da apposite commissioni per la nomenclatura in base a criteri che risultino via via accettati (fig. 1, 2). Per es., è stato stabilito che due v. della medesima famiglia costituiscono due tipi distinti quando l’omologia del loro genoma sia inferiore al 50%. Nella pratica i virologi continuano a indicare i v. secondo la nomenclatura comune, cioè con il nome v. seguito da quello della malattia determinata nell’ospite principale: per es., v. della parotite, v. dell’influenza, v. del morbillo, v. del mosaico del tabacco (fig. 3) ecc., oppure con il nome che gli è stato attribuito al momento dell’isolamento (per es. v. Ebola, di Epstein-Barr, di Norwalk ecc.). L’attuale classificazione si basa sul tipo di genoma (DNA o RNA) e sulla sua configurazione (mono- o bicatenario, lineare o circolare, monofilamento o segmentato, a polarità positiva o negativa), sul tipo di simmetria (cubica o elicoidale), sulla presenza oppure sull’assenza di involucro pericapsidico e, infine, sul meccanismo di replicazione. Le famiglie di v. che possono infettare l’Uomo e quindi di rilevanza medica sono riportate in tabella.
La replicazione virale inizia con l’adsorbimento del v. alla cellula, fenomeno che richiede un’interazione tra specifiche strutture di superficie del virione (antirecettori) e recettori della membrana citoplasmatica della cellula. All’adsorbimento segue poi la penetrazione del v., che può avvenire per traslocazione del virione attraverso la membrana cellulare, per endocitosi all’interno di vacuoli citoplasmatici o per fusione dell’involucro pericapsidico del v. con la membrana citoplasmatica cellulare. All’interno della cellula, l’acido nucleico virale viene liberato da quanto rimane del rivestimento proteico (decapsidazione) e inizia a essere espresso. Dal momento in cui il v. penetra nella cellula a quello in cui cominciano a prodursi i primi virioni di progenie, esso non è più rilevabile nella cellula come entità infettante, motivo per il quale questo periodo è stato chiamato fase di eclisse. Questa è caratterizzata da un’intensa attività metabolica per consentire l’espressione del genoma virale, la sua replicazione e la produzione delle proteine strutturali che andranno a costituire i virioni di progenie. Tali fasi sono dirette dal v. secondo strategie replicative caratteristiche di ciascun gruppo. La replicazione virale si completa con il montaggio (o assemblaggio) delle subunità proteiche virali che, racchiudendo l’acido nucleico ed eventuali altri componenti interni, formano i virioni di progenie. Per alcuni v. il montaggio dei virioni coincide con la maturazione. Altri v. debbono invece subire ulteriori modificazioni prima di maturare; tra queste vi sono l’acquisizione dell’involucro pericapsidico e la ridistribuzione delle proteine del nucleocapside. La replicazione termina con la liberazione delle particelle virali dalla cellula ospite, che nella maggior parte dei v. nudi avviene per lisi della cellula, mentre nella maggior parte dei v. rivestiti avviene per gemmazione dalla membrana citoplasmatica. Quando la replicazione virale si verifica in maniera completa con produzione di progenie, si parla di infezione produttiva. In cellule sensibili ma non permissive, tuttavia, l’infezione può portare all’espressione di alcuni geni virali soltanto – si parla allora di infezione abortiva – e la cellula ospite può pertanto sopravvivere. In questo caso se i geni virali espressi sono capaci di attivare il DNA cellulare, la cellula sopravvissuta può risultare trasformata. Infine, se la cellula è permissiva solo in certe condizioni, per es. di attivazione, la replicazione può arrestarsi con il cambio di stato della cellula e riprendere quando lo stato di origine venga ripristinato: in questi casi l’infezione può, quindi, diventare latente.
Effetti sulla cellula
La moltiplicazione virale produce nella cellula ospite modificazioni che, salvo eccezioni, ne alterano lo stato fisiologico: possono derivarne cambiamenti della morfologia cellulare e alterazioni metaboliche, genetiche o regolatorie, che causano la morte della cellula (infezioni citocide) o la sua trasformazione in senso neoplastico. Nelle infezioni citocide le alterazioni morfologiche, caratteristiche per i vari gruppi di v., sono definite effetto citopatico, che può essere rappresentato da una degenerazione ‘palloniforme’ e dalla successiva lisi, dalla formazione di cellule giganti multinucleate (sincizi) oppure dalla formazione di ammassi di costituenti virali e/o di strutture cellulari alterate nel nucleo o nel citoplasma della cellula (in tal caso si parla di inclusioni). Molti v. inoltre inibiscono la sintesi delle macromolecole cellulari (DNA, RNA e proteine), impedendo così alla cellula di riparare i danni da usura o prodotti dal virus. Talvolta, si possono produrre rotture cromosomiche che, se l’infezione abortisce e la cellula sopravvive, ne modificano stabilmente l’assetto genetico. Nelle infezioni trasformanti, la cellula infetta, anziché andare incontro alla morte, può subire la trasformazione e assumere le caratteristiche di cellula tumorale. Perché ciò avvenga è di regola necessario che il genoma virale completo o una sua parte rimanga in forma episomica o integrato nel DNA cellulare. La trasformazione tumorale si stabilisce in due fasi successive, nella prima delle quali la cellula acquisisce la capacità di moltiplicarsi indefinitamente (immortalizzazione). Nelle cellule immortalizzate può, quindi, verificarsi un secondo evento (promozione) che fa loro perdere la cosiddetta inibizione da contatto, un fenomeno per cui esse smettono di dividersi quando si trovano a contatto con altre cellule adiacenti. È stato accertato che i v., attraverso meccanismi complessi, possono influire su entrambe le fasi.
Genetica dei virus
In generale si può affermare che i v. sono in una continua evoluzione genetica che tende a un sempre migliore adattamento al proprio ospite, processo che inizia in maniera casuale durante la replicazione. Se il cambiamento genetico non altera la capacità riproduttiva del v., esso si potrà trasmettere alla progenie virale ed eventualmente stabilizzarsi nella popolazione. I cambiamenti genetici che ledono in maniera significativa la capacità replicativa del v. risultano eliminati dalla popolazione virale. Anche le alterazioni che causano lievi danni alla capacità replicativa virale tendono a essere eliminate perché il v. originario si replica con maggiore velocità o efficienza. Tuttavia, se sussiste una condizione esterna (per es. la presenza di un farmaco antivirale) che conferisce al variante (per es. un ceppo resistente al farmaco) un vantaggio rispetto alla popolazione originaria, la popolazione mutata si affermerà rapidamente sostituendosi a quella preesistente.
Tra i meccanismi responsabili di alterazioni ereditarie delle caratteristiche virali, il più frequente è rappresentato dalle mutazioni puntiformi, le quali sono dovute generalmente a errori nell’incorporazione di un nucleotide nel corso della replicazione del genoma e la cui frequenza dipende, quindi, dall’accuratezza degli enzimi impegnati nella replicazione del virus. I v. che utilizzano una DNA polimerasi presentano una frequenza di mutazione relativamente bassa, perché l’enzima è in grado di correggere eventuali errori commessi durante la copiatura dello stampo. I v. che utilizzano come enzima replicativo una RNA polimerasi sono invece privi di attività di correzione e pertanto sono più esposti a errori di copiatura. Nelle popolazioni virali già adattate all’ospite, di regola, si è già selezionata quella più idonea, per cui raramente le mutazioni che intervengono risultano vantaggiose, ma sono nella maggioranza dei casi indifferenti, letali o parzialmente deleterie. Una mutazione indifferente o parzialmente deleteria può conferire al v. che la possiede un vantaggio selettivo in alcune situazioni in cui il ceppo selvaggio è svantaggiato, come per es. in presenza di un farmaco attivo solo se il gene in questione è nella sua conformazione originaria, o nel caso in cui l’ospite sviluppa una risposta immunitaria verso il determinante antigenico originario. In questo caso, le varianti virali si affermeranno tanto più rapidamente quanto più grande sarà il vantaggio selettivo conferito dalla mutazione. Il fenomeno relativo all’accumulo progressivo di mutazioni, con conseguente variazione antigenica, è indicato come deriva antigenica.
Quando due v. con differenze genetiche coinfettano la stessa cellula, possono andare incontro a ricombinazione, cioè allo scambio di tratti omologhi di materiale genetico, da cui consegue un cambiamento radicale delle caratteristiche genetiche della popolazione virale. Per i v. a DNA questo fenomeno si verifica per interruzione e risaldatura di segmenti neosintetizzati, mentre per i v. a RNA la ricombinazione avviene durante la replicazione, per salto dell’enzima replicativo da un filamento/stampo a un altro. Il riassortimento genomico è un tipo estremo di ricombinazione che si può verificare per i v. che possiedono un genoma organizzato in segmenti distinti (Orthomyxoviridae, Reoviridae ecc.). La cellula infettata contemporaneamente da due v. diversi con genoma segmentato contiene segmenti di entrambi i v. parentali che, durante il montaggio e la maturazione, possono essere casualmente distribuiti nei virioni di progenie. Ne risulteranno, quindi, virioni dalle caratteristiche intermedie tra i due v. parentali e, se queste conferiscono un vantaggio selettivo, i v. ricombinanti verranno favoriti dalla selezione. Il fenomeno, analogo alla segregazione indipendente dei cromosomi negli eucarioti, viene anche definito mescolamento genotipico. I v. ricombinanti possono differire sensibilmente dai v. parentali, dal punto di vista sia antigenico sia biologico. Così, mentre da una parte un cambiamento antigenico profondo (chiamato shift antigenico) può trovare l’ospite abituale privo di difese immunitarie specifiche, dall’altra i v. ricombinanti possono invadere nuove nicchie replicative in ospiti differenti.
Alcuni v. possono utilizzare funzioni di altri v. della stessa specie oppure di specie affini quando presenti contemporaneamente nella stessa cellula ospite. Questo fenomeno, detto complementazione, può riattivare infezioni sostenute da v. difettivi, ma non è stabile, in quanto la progenie a sua volta mancherà della funzione genetica mutuata dal v. complementante, comunemente chiamato helper. Alcuni v. stabiliscono un rapporto di parassitismo stabile (v. satelliti) con altri v. non necessariamente affini, derivando da questi alcune funzioni delle quali sono privi, come la glicoproteina dell’involucro nel caso del v. dell’epatite Delta (HDV, Hepatitis D virus), che è fornita dal virus dell’epatite B (HBV, Hepatitis B virus).
Le malattie da v. possono essere classificate sulla base degli organi bersaglio interessati dall’infezione.
Apparato cardiorespiratorio
Le infezioni virali dei vasi e del cuore non sono state ancora clinicamente inquadrate con la stessa chiarezza di quelle che interessano altri apparati. Il motivo è certamente da attribuirsi al fatto che l’apparato cardiocircolatorio può essere occasionalmente interessato da vari v. senza però rappresentare, per nessuno di essi, il principale organo bersaglio. Le infezioni respiratorie rappresentano le più frequenti affezioni dell’Uomo; sono causate da almeno 200 tipi di v. differenti.
Sistema nervoso
Le infezioni virali del sistema nervoso sono rappresentate da rare, ma spesso gravissime, complicanze di infezioni sistemiche. La rarità è dovuta al fatto che il sistema nervoso centrale è protetto dalla barriera ematoencefalica, mentre la gravità è da attribuire, in parte, al fatto che il sistema nervoso centrale non possiede un sistema immunitario intrinseco e che il traffico di quello sistemico è ostacolato dalla barriera ematoencefalica. Le manifestazioni cliniche a carico del sistema nervoso centrale possono presentarsi sotto forma di meningiti, encefaliti, paralisi e affezioni neurologiche progressive a lungo decorso. I principali v. coinvolti in questo contesto sono i v. erpetici, il v. del morbillo, l’HIV e alcuni tra i Picornavirus, i Togavirus e i Flavivirus.
Cute e mucose
La cute e le mucose costituiscono generalmente una valida barriera alla penetrazione dei v., essendo ricoperte la prima di uno strato impermeabile di cellule morte e le seconde di uno strato di muco continuamente sospinto verso l’esterno dal movimento ciliare. Tuttavia interruzioni della continuità possono aprire la via alla penetrazione dei v. e far sì che la stessa cute e le mucose diventino bersaglio e sede di infezioni virali localizzate (per es. sostenute da Herpesvirus e Papillomavirus). Talvolta la cute e le mucose possono essere sede della localizzazione di infezioni provenienti da altri distretti dell’organismo, come nel morbillo, rosolia, varicella-zoster, Herpes simplex, Herpesvirus 6, Enterovirus, Arbovirus, Parvovirus B19 e alcuni Poxvirus.
Apparato digerente
Tra i v. responsabili delle infezioni del cavo orale si ricordano Herpes simplex di tipo I, alcuni Enterovirus e il v. di Epstein-Barr. Tra i v. che mostrano tropismo per l’apparato intestinale, causando talvolta gravi enteriti, possono essere citati i Rotavirus, il v. Norwalk e gli Adenovirus enterici. I Papovavirus possono invece interessare il tratto distale dell’intestino. Il coinvolgimento del fegato può occasionalmente avvenire nel corso di infezioni da vari v., detti appunto v. epatitici minori per differenziarli dai v. epatitici propriamente detti, che hanno invece il fegato come principale organo bersaglio. Tra i v. minori (parotite, morbillo, Coxsackie, Epstein-Barr, Herpesvirus, Adenovirus, Cytomegalovirus), la localizzazione epatica è di regola un epifenomeno nel quadro clinico della malattia di base. I v. epatitici veri e propri, con prevalente o esclusivo interessamento epatico, sono i v. dell’epatite A, B, C, D (o Delta) ed E. Essi appartengono a famiglie diverse e hanno caratteristiche genetiche e biologiche differenti; possono tuttavia essere suddivisi in: v. che danno esclusivamente epatiti acute (v. A ed E a trasmissione orofecale) e v. che tendono a produrre forme croniche di infezione (v. B, C e D a trasmissione parenterale). Sono stati inoltre identificati il v. epatotropo, definito v. G, la cui attività patogena è ancora incerta e il TTV (trans;fusion trasmitted virus).
Sistema linfoide ed ematopoietico
I v. entrano nel sistema circolatorio tramite drenaggio linfatico di tessuti infetti. Altri v. possono essere introdotti direttamente in circolo, tramite inoculazione da Artropodi, o da traumi causati da animali od oggetti infetti, o per introduzione di sangue, emoderivati o tessuti umani infetti. Le patologie associate alla replicazione dei v. al livello del sistema linfoide ed ematopoietico sono le sindromi linfoproliferative (principalmente causate da v. di Epstein-Barr, Cytomegalovirus e Herpesvirus 6 e 7), aplasie e leucopenie (principalmente da Parvovirus B19 e HIV), linfomi e leucemie (principalmente dai virus HTLV-I e II, human T-cell leukemia virus).
Feto
I v. più comunemente trasmessi durante la gestazione sono il v. della rosolia, il Cytomegalovirus, l’HIV e, in misura molto minore, il v. varicella-zoster, i v. dell’epatite B e C e il v. dell’herpes simplex, che possono essere invece trasmessi per infezione perinatale. Nella maggior parte di questi casi il v., proveniente dal torrente circolatorio, attraversa la placenta e si impianta nei tessuti fetali in rapida crescita, determinando un danno che è tanto più grave quanto più precoce è lo stadio di sviluppo fetale. Tuttavia non tutte le infezioni fetali hanno effetti devastanti e in alcuni casi l’unica testimonianza dell’avvenuta trasmissione fetale è la persistente eliminazione di v. da parte del neonato per un lungo periodo dopo la nascita.
Danni provocati dai virus
I v. possono causare direttamente alterazioni più o meno rilevanti. Frequentemente sono apprezzabili modificazioni istopatologiche che rappresentano la conseguenza dell’effetto citopatico e di altri effetti citolesivi causati dai v.: vacuolizzazioni, policariocitosi, cellule giganti, picnosi, inclusioni citoplasmatiche e nucleari, alterazioni cromosomiche ecc. Queste alterazioni rivestono un’importanza fondamentale nella genesi di gran parte delle manifestazioni patologiche che caratterizzano molte malattie virali. Le paralisi flaccide della poliomielite, per es., sono causate dalla necrosi dei neuroni motori determinata da poliovirus che raggiungono le corna anteriori del midollo spinale.
I v. possono, tuttavia, causare modificazioni funzionali delle cellule anche in assenza di alterazioni morfologicamente apprezzabili. Il v. della rabbia, per es., quando si moltiplica nei neuroni, ne altera le funzioni recettoriali portando al quadro clinico drammatico che caratterizza la malattia.
Le conseguenze dell’azione diretta dei v. dipendono in gran parte dal tipo di cellule colpite. La distruzione di cellule, come quelle nervose e cardiache che esercitano funzioni vitali e sono incapaci di rigenerare, porta a malattie gravi e irreversibili, mentre lesioni a carico delle cellule che svolgono funzioni meno critiche e che comunque possono rigenerare rapidamente, come quelle dell’epitelio intestinale, provocano malattie meno gravi e che possono recuperare con maggiore facilità. La reazione dell’ospite all’infezione virale, se ben calibrata per ampiezza e intensità, porta alla eradicazione dell’infezione. Spesso, tuttavia, è un eccesso di risposta dell’ospite che può concorrere in maniera indiretta a generare il quadro istopatologico e clinico delle virosi. I danni patologici possono infatti essere prodotti attraverso le risposte infiammatorie e immunitarie che l’organismo stesso mette in atto per difendersi. Sia gli anticorpi, sia le risposte cellulo-mediate possono contribuire in maniera determinante alla genesi degli effetti patologici prodotti nelle infezioni virali, soprattutto quando il v. è scarsamente citolesivo. I complessi immuni che si formano nel corso di un’infezione virale possono in particolari condizioni depositarsi sulle membrane basali dei glomeruli renali, nelle arteriole della cute e di altri distretti e nelle articolazioni, provocandovi fenomeni infiammatori. Inoltre, in alcune infezioni virali si innescano processi autoimmunitari che sono stati chiamati in causa, congiuntamente ad altri fattori, nella genesi di alcune malattie autoimmuni.
Virosi delle piante
Nelle piante le virosi si manifestano con sintomi diversi a seconda dell’agente causale e della specie colpita, determinando danni economici spesso gravissimi. Talora vi è mancanza assoluta di alterazioni visibili e le piante vengono definite ‘portatori mascherati di virus’. In altri casi le alterazioni prodotte dall’infezione virale sono manifeste e le piante colpite possono presentare sulle foglie mancata o ridotta formazione di cloroplasti (mosaico o giallume più o meno intensi), macchie ad anello, necrosi della lamina fogliare, delle nervature e del fusto, variazioni di colore nei fiori, anomalie di sviluppo (nanismo, arricciamento e accartocciamento delle foglie, foglie a rosetta, deformazioni del fusto, tumori ecc.).
La trasmissione delle virosi vegetali avviene spesso attraverso le varie forme di moltiplicazione agamica delle piante, cioè per mezzo di tuberi, bulbi, talee e innesti; altre volte i v. vegetali possono essere trasmessi attraverso microscopiche lesioni causate da sfregamento, ma nella maggior parte dei casi il trasporto da una pianta all’altra avviene per mezzo di insetti che fungono da vettori. Raramente la trasmissione può avvenire attraverso il terreno (nematodi) e i semi.
Le piante più danneggiate sono tabacco, pomodoro, bietola, broccoli, barbabietole, patate, agrumi, alberi da frutto, vite e diversi tipi di cereali. Anche molte piante ornamentali, quali gigli, fresie, gladioli, dalie, rose sono soggette a v.; per es., alcune screziature dei fiori come le striature bianche del tulipano, che un tempo si credeva fossero tipiche di una caratteristica varietà, sono dovute a virus. Presentano virosi anche molte piante spontanee.
La lotta contro le virosi vegetali è difficile e basata essenzialmente su metodi indiretti (selezione di materiale sano da usare per la moltiplicazione vegetativa, scelta del seme da piante sicuramente esenti da v., scelta di varietà resistenti, lotta contro gli insetti vettori, distruzione delle piante malate). L’ingegneria genetica ha aperto nuovi orizzonti nella lotta contro le virosi delle piante con l’introduzione nel genoma delle piante di caratteri di resistenza ai v. e ai vettori. Viromorfosi è la modificazione della forma e della struttura determinata dall’azione di un v.; per es., nel mosaico del tabacco si notano foglie nastriformi e filiformi, enazioni ecc.
Sviluppi della virologia
La virologia è la disciplina biologica che ha come oggetto lo studio dei virus. Come per le altre scienze, il suo sviluppo non è avvenuto lungo una direttiva precisa ma per un lento accumulo di conoscenze empiriche.
Nel 1886 il chimico agrario tedesco A. Mayer dimostrò la trasmissibilità di una malattia della pianta del tabacco caratterizzata dalla particolare distribuzione a mosaico di aree verde scuro e verde chiaro nelle foglie infette. Nel 1898 il botanico olandese M. Beijerinck dimostrò che alcune infezioni potevano essere prodotte da entità più piccole e più semplici dei batteri. Da allora la parola virus, che in latino significa melma, fetore, veleno, fu impiegata per indicare quegli agenti infettivi che, per la loro piccolezza, non potevano essere osservati al microscopio ottico e che oltrepassavano i filtri capaci di trattenere i batteri. Nel 1898 la scoperta della filtrabilità dei v. fu confermata per un v. degli animali, quello dell’afta epizootica del vitello, autonomamente da due ricercatori, F. Loeffler e P. Frosch, e nel 1901 da W. Reed per un v. umano, l’agente della febbre gialla, trasmesso all’Uomo dalla puntura di alcune zanzare (Aedes aegypti). V. Ellerman e O. Bang nel 1908 in Danimarca dimostrarono la trasmissibilità della leucemia aviaria, e P. Rous nel 1911 negli USA dimostrò l’origine virale del sarcoma dei polli. Nel 1915 F. Twort e, indipendentemente, nel 1917 F. D’Hérelle individuarono v. capaci di infettare i batteri, i batteriofagi. Nel 1923 W. Harvey e H. Acton allestirono tecniche quantitative per lo studio sperimentale di v. in animali da esperimento. Tuttavia solo nel 1930 si riuscì ad avere l’impiego sistematico dei topi nella titolazione del v. della rabbia (A. Hoyot) e della febbre gialla (M. Theiler). Metodi di saggio per l’infettività di v. vegetali furono messi a punto da F. Holmes nel 1929 e da G. Samuel e J. Bald nel 1933.
La coltura su larga scala dei v. si ottenne solo dopo l’introduzione delle colture in vitro di tessuti di mammiferi (H. Maitland e M. Maitland, 1928) e delle uova fecondate di pollo (A. Woodruff e E. Goodpasture, 1930). Nel 1933 M. Schlesinger dimostrò che un batteriofago era costituito da DNA e proteine. W. Stanley dimostrò nel 1935 che il v. del mosaico del tabacco purificato cristallizzava come una comune proteina e che i cristalli ridisciolti erano capaci di iniziare un nuovo ciclo di infezione. Le importanti ricerche sui batteriofagi eseguite fra il 1945 e il 1960 da S. Luria, A. D. Hershey, A. Lwoff e da molti altri ricercatori, fecero della virologia una scienza quantitativa e fornirono le basi per le ricerche di biologia molecolare e di ingegneria genetica. Lwoff chiarì uno dei problemi più difficili della batteriologia, la lisogenia, inducendo con raggi UV cellule batteriche lisogeniche. A.D. Hershey e M. Chase dimostrarono, nel 1952, il ruolo degli acidi nucleici nel processo di infezione virale.
Nel 1956 J. Watson e F. Crick contribuirono a dare una più precisa e moderna definizione di tali microrganismi: i v. costituiscono un gruppo di parassiti cellulari obbligati, definiti come organizzazioni biologiche caratterizzate da un livello subcellulare di strutturazione, in quanto costituiti essenzialmente da acido nucleico (RNA o DNA) racchiuso in un contenitore di natura proteica con la duplice funzione di proteggere il materiale genetico quando il v. si trova in ambiente extracellulare e di mediarne la penetrazione intracellulare interagendo con la superficie delle cellule ospiti. Il v. dell’epatite A è stato isolato da S. Krugman nel 1960 e, nel 1963, con la scoperta dell’antigene Australia di B. Blunberg, è stato individuato il v. dell’epatite B. Nel 1977 M. Rizzetto ha chiarito l’eziologia dell’epatite D, nel 1989 M. Houghton quella dell’epatite C e D. Bradley dell’epatite E.
Fra gli anni 1980 e 1990 sono stati caratterizzati gli oncogeni a opera di J. Bishop e R. Weinberg e isolati, da parte dei gruppi di ricerca di R. Gallo negli USA e di L. Montagnier in Francia, due retrovirus umani che causano patologie leucemiche e neurologiche (HTLV, v. umani linfotropi per le cellule T, I e II) e altri due retrovirus responsabili della sindrome immunodepressiva, nota come sindrome da immunodeficienza acquisita, AIDS (HIV, v. dell’immunodeficienza umana, tipo 1 e 2).
Informatica
Tipologia di malware, termine con il quale si indicano i software progettati e realizzati per arrecare danni più o meno gravi con varie modalità al calcolatore sul quale sono eseguiti. Talvolta il termine v. è utilizzato come sinonimo di malware. Tali software hanno caratteristiche simili a quelle dei v. biologici, da cui prendono il nome: non possono essere eseguiti autonomamente, senza un programma ospite; sono in grado di individuare possibili file da infettare e di replicarsi, contagiando questi ultimi. Storicamente trasmessi da un calcolatore all’altro attraverso lo scambio di floppy disk, si sono evoluti di pari passo con i calcolatori e i software, sfruttandone tutti i punti di debolezza, e con i moderni sistemi di comunicazione tra calcolatori e/o utenti, usandoli come mezzo di propagazione, con una netta predilezione per Internet e nella fattispecie reti peer-to-peer ed e-mail. I v. possono essere anche realizzati per causare danni più o meno gravi che vanno dalla semplice notifica di infezione all’utente, per es. mediante la comparsa di messaggi sul display o la riproduzione di file multimediali audio/video, alla cancellazione di file fino alla formattazione dell’hard disk.
Per individuare e rimuovere i v. sono stati ideati software dedicati, detti antivirus, che si avvalgono di una base di dati di v. noti e/o di euristiche per individuarne di nuovi.
© Istituto della Enciclopedia Italiana - Riproduzione riservata