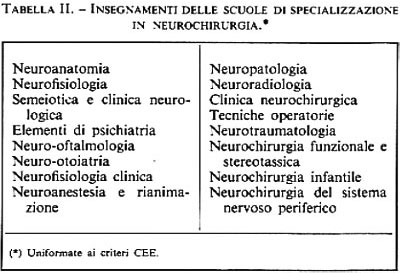
Chirurgia
Enciclopedia del Novecento I Supplemento (1989)
CHIRURGIA
Cardiochirurgia di Charles Dubost
sommario: 1. Introduzione. 2. La circolazione extracorporea: a) generalità; b) gli ossigenatori; c) la protezione del miocardio; d) il decorso postoperatorio; e) la riattivazione cardiaca in sala di rianimazione. 3. Le cardiopatie congenite: a) le cardiopatie congenite non cianogene; b) le cardiopatie congenite cianogene; c) la chirurgia del lattante. 4. Le cardiopatie acquisite: a) le malattie delle valvole cardiache; b) le miocardiopatie. 5. La chirurgia delle coronarie: a) esami speciali; b) progressi tecnici; c) risultati della chirurgia di rivascolarizzazione del miocardio; d) indicazioni operatorie. 6. Altre indicazioni della chirurgia cardiaca: a) la rottura recente del setto interventricolare; b) gli aneurismi del ventricolo; c) il trattamento chirurgico di alcune alterazioni del ritmo. 7. La chirurgia degli aneurismi dell'aorta toracica: a) gli aneurismi dell'aorta ascendente; b) gli aneurismi dell'arco aortico; c) gli aneurismi dell'aorta toracica discendente; d) gli aneurismi dell'aorta toracoaddominale. 8. Trapianti cardiaci: a) il trapianto ortotopico; b) il trapianto eterotopico; c) l'allotrapianto cuore-polmoni; d) indicazioni dei trapianti cardiaci. 9. Il cuore artificiale meccanico: a) la pompa cardiaca; b) la fonte di energia e il convertitore di energia; c) il sistema di regolazione; d) conseguenze applicative degli studi; e) ricerche sperimentali. 10. L'assistenza cardiocircolatoria: a) assistenza con palloncino pulsante intra-aortico; b) assistenza mediante cuore-polmoni artificiale; c) ventricolo sinistro ausiliario. 11. Gli stimolatori cardiaci. □ Bibliografia.
1. Introduzione
In tutta la storia della chirurgia non si è mai avuta una partenza tanto folgorante né realizzazioni così notevoli come quelle che hanno portato, in meno di quattro decenni, dalla legatura del dotto arterioso al trapianto cardiaco, passando per tutta una serie di operazioni volte a correggere cardiopatie congenite e malattie cardiache acquisite.
Ripetuti successi hanno aperto al chirurgo nuovi settori della cardiologia: il terreno particolare della malattia coronarica ne è l'ultimo esempio.
Oggi abbiamo raggiunto il distacco sufficiente per esaminare con occhio critico una branca della chirurgia ormai demitizzata, nella quale i compiti quotidiani, spesso monotoni per il chirurgo, offrono più speranza al malato che entusiasmo all'operatore.
Nonostante i successi, resta ancora molto da fare e molte domande sono tuttora senza risposta. In queste poche pagine cercherò di sottolineare che cosa ci si può attendere per il futuro, alla luce delle acquisizioni degli ultimi anni. Avrò cura di non trarre un autocompiacimento, a volte immeritato, dalla valutazione di quanto è ormai acquisito e di non abbandonarmi a un delirio sofisticato, ispirato alle migliori opere fantascientifiche e nato dalla speranza di raggiungere traguardi all'altezza del XXI secolo.
Mi sforzerò di presentare prima il bilancio delle realizzazioni di routine della cardiochirurgia, basato sullo studio di grandi serie di dati, di studiare poi i loro possibili miglioramenti e di affrontare infine le ricerche attuali su determinati gruppi di malati per i quali è ragionevole prevedere un notevole miglioramento delle possibilità chirurgiche e dei risultati ottenibili negli anni futuri.
Mi sembra però utile ricordare brevemente la storia della cardiochirurgia, prima per mostrare il concatenamento dei fatti, poi per notare l'evoluzione del pensiero delle équipes di ricerca che hanno operato durante tutti questi anni.
Più che in qualunque altro campo della chirurgia la ricerca ha avuto, ha e avrà un posto privilegiato nella nostra specialità: ricerca clinica, nelle operazioni quotidiane, ma anche ricerca applicata e ricerca di base, particolarmente ricca oggi che la tappa biologica della chirurgia cardiaca segna uno sviluppo sorprendente.
Non dovrebbe essere necessario ricordare l'operazione di Blalock-Taussig, che resta senza dubbio la più famosa di tutte (non solo perché fu la prima, ma anche perché riuscì a trasformare radicalmente l'aspetto dei bambini portatori di tetralogia di Fallot) e rappresenta lo sbocco di un lungo periodo di sperimentazione.
L'orientamento iniziale dell'operazione mirava a tutt'altro scopo, poiché Alfred Blalock realizzava sugli animali anastomosi fra l'arteria succlavia e l'arteria polmonare allo scopo di creare una ipertensione arteriosa polmonare (senza però mai riuscirvi). Hélène Taussig gli chiese di applicare la sua tecnica, già a buon punto, per alimentare il polmone privo di sangue dei bambini portatori di tetralogia di Fallot, argomentando, appunto, che tale anastomosi non avrebbe determinato ipertensione polmonare. Blalock si lasciò convincere ed eseguì le prime operazioni sui bambini: fu un immenso successo che si propagò nel mondo del secondo dopoguerra, avido di novità e ansioso di recar sollievo a migliaia di bambini fino allora condannati.
Insieme a F. d'Allaines fummo fra i primi in Europa a creare un centro di chirurgia cardiaca, a Parigi, riservato inizialmente alle malattie congenite e poi ben presto, dal 1950, aperto anche ad alcune malattie acquisite, in particolare la stenosi mitralica che allora veniva operata alla cieca. Lo scopo restava quello di operare a vista, all'interno del cuore, per fare un lavoro esatto e corrispondente alla necessità.
Il raffreddamento del malato mediante ipotermia di superficie offrì presto la possibilità di interrompere la circolazione per i pochi minuti necessari alla chiusura di una comunicazione interauricolare semplice o all'apertura di una stenosi polmonare. Poi, nel 1954-1955, la creazione del cuore-polmoni artificiale mi permise di realizzare la prima operazione in condizioni di circolazione extracorporea in Francia.
A partire dal 1955, dunque, eravamo in grado di aprire il cuore e di intervenire su numerose malformazioni congenite, ma le malattie acquisite erano ancora al di là delle nostre possibilità per mancanza di valvole artificiali. Le prime protesi furono disponibili nel 1960, e da quel momento la cardiochirurgia è stata in grado di affrontare la maggior parte delle malattie cardiache, congenite e acquisite. Restava la malattia coronarica, ma il ponte aortocoronaro, realizzato da Favaloro negli Stati Uniti nel 1968, doveva aprire nuovi orizzonti.
Prima di proseguire lo studio dei vari aspetti della chirurgia del cuore, mi sembra importante sottolineare i fattori che hanno permesso la nascita e lo sviluppo di questa nuova branca della medicina.
In primo luogo la scoperta del cateterismo cardiaco e dell'angiocardiografia ha permesso di formulare diagnosi precise, indicando al chirurgo la localizzazione e la natura di una stenosi, di una comunicazione anomala fra le cavità cardiache, o l'alterazione dell'una o dell'altra valvola del cuore. I progressi dell'anestesia, che permettono di realizzare interventi di parecchie ore all'interno del torace, la possibilità di mantenere l'equilibrio umorale per tutta la durata dell'operazione, la rianimazione postoperatoria sempre più sofisticata, e oggi in gran parte computerizzata, spiegano i successi sempre più numerosi e sempre più ambiziosi. Alla timida circolazione extracorporea dei primi tempi si è sostituito un sistema cuore-polmoni di tecnologia avanzata, che utilizza flussi pulsanti e apporta all'organismo sangue ossigenato da ossigenatori a membrana di elevate prestazioni.
Bisogna anche sottolineare il ruolo primario delle ricerche nel campo della ‛biotecnologia', che hanno fornito probabilmente l'apporto più importante di questi ultimi anni, dando origine alle valvole artificiali meccaniche o animali - queste ultime trattate con glutaraldeide - e agli ossigenatori a fibre cave, per non parlare delle ricerche nel campo del cuore artificiale meccanico e della miniaturizzazione degli stimolatori cardiaci.
2. La circolazione extracorporea
a) Generalità
Chirurgia cardiaca è oggi sinonimo di chirurgia sotto controllo della vista; in effetti le operazioni dei primi anni, che erano praticate alla cieca a cuore chiuso o, per certe particolari lesioni, erano realizzate sotto controllo della vista durante i pochi minuti dell'arresto circolatorio reso possibile dall'ipotermia moderata di superficie, fanno ormai parte della storia della chirurgia e sono oggi pressoché abbandonate. Queste tecniche, tuttavia, hanno incontestabilmente permesso di migliorare le condizioni di numerosi pazienti e la commissurotomia mitralica eseguita alla cieca conserva ancora oggi una funzione in casi particolari di età, di sesso e sopratutto di etnia. L'ipotermia moderata ha rappresentato il metodo più semplice per interrompere la circolazione intracardiaca: si limita ad abbassare con mezzi fisici la temperatura del paziente in anestesia fino a circa 31 °C in modo che si possa approfittare dei 6 o 7 minuti di arresto circolatorio resi possibili dalla diminuzione dei bisogni metabolici per aprire l'orecchietta o l'arteria polmonare ed effettuare un intervento chirurgico semplice e rapido come quello che consente l'apertura di una stenosi polmonare - purché si abbia la prova certa della sua collocazione valvolare - o la chiusura di una comunicazione interatriale, purché si tratti di un ostium secundum isolato.
Attualmente il perfezionamento della circolazione extracorporea offre al malato possibilità di cura infinitamente superiori, permettendo al chirurgo di affrontare e riparare praticamente tutte le lesioni cardiache, congenite e acquisite. In effetti la cardiochirurgia è il prototipo di una chirurgia ricostruttiva e riparatrice in molte fra le sue indicazioni, e questa è, senza alcun dubbio, la sua caratteristica principale, almeno, come vedremo, per quanto concerne la maggioranza delle cardiopatie congenite.
Lo schema della circolazione extracorporea è semplice. Il principio è quello di far defluire il sangue venoso del malato in un serbatoio discendente, facendolo poi passare in un ossigenatore che sostituisce il polmone, da dove viene distribuito, mediante una pompa che sostituisce il cuore, nel sistema arterioso dell'operato. In queste condizioni il chirurgo può aprire il cuore e praticare nella sua cavità le diverse operazioni di ricostruzione o di trasformazione occorrenti
Fu presto evidente che occorreva praticare su questo circuito di base un certo numero di aggiustamenti per permettere al chirurgo di agire con più agio e per ottenere una migliore tolleranza da parte del cuore.
Operare su un cuore mantenuto pulsante complicava l'atto operatorio: all'iniziale arresto cardiaco ottenuto con l'impiego di farmaci, e ben presto ritenuto deleterio per le cellule del miocardio, venne sostituita l'induzione elettrica della fibrillazione ventricolare. Però anche questa non risultava completamente innocua, per cui si passò a raccomandare la perfusione continua delle arterie coronarie in modo da mantenere un grado ottimale di ossigenazione a livello delle cellule miocardiche. L'ipotermia associata con la circolazione extracorporea permette di modulare in modo molto sottile, conciliandoli, i desideri del chirurgo e le esigenze del cuore. Se si inserisce nel circuito della circolazione extracorporea un apparecchio capace di trasmettere al sangue che lo attraversa un raffreddamento o un riscaldamento rapidi, si realizza uno scambio termico che permette di abbassare la temperatura dell'intero corpo del malato nei limiti dell'ipotermia moderata (28-30 °C) o dell'ipotermia profonda (16-24 °C). Questo abbassamento termico regolabile secondo le esigenze presenta numerosi vantaggi. L'ipotermia, abbiamo già detto, riduce il fabbisogno di ossigeno dell'organismo e permette, quando è poco spinta, di ridurre il volume di perfusione; più spinta, rende possibile l'interruzione completa della circolazione artificiale per periodi che possono anche superare i trenta minuti. Dal 1959, beneficiando dei lavori della scuola americana, potemmo praticare l'uso deliberato dell'ipotermia profonda con arresto della circolazione per la cura delle malattie cardiache congenite o acquisite. Non avevamo ancora registrato alcuna complicazione dovuta a questo metodo quando, alla fine del 1961, sopravvennero una dopo l'altra tre complicazioni molto gravi di tipo coreo-atetosico, che ci imposero di rivedere la nostra concezione della circolazione extracorporea associata con l'ipotermia profonda. Così, dagli inizi del 1962 siamo stati portati a diminuire notevolmente le applicazioni dell'ipotermia profonda, sopprimendola completamente nei bambini e conservandola negli adulti solo in casi rari e ben determinati, con abbassamento termico meno profondo e arresto circolatorio meno prolungato.
La grande maggioranza delle operazioni a cuore aperto effettuate da allora sono avvenute accoppiando alla circolazione extracorporea un abbassamento termico moderato (28-30 °C) con perfusione continua. Perciò l'inclusione di uno scambiatore termico nel circuito di perfusione ci sembra indispensabile, perché offre grande elasticità di impiego e permette, se occorre, l'utilizzazione di brevi periodi di arresto circolatorio resi possibili da un abbassamento termico più spinto (v. De Wall e altri, 1957; v. Dubost e altri, Les possibilités..., 1952, Elargissement..., 1956, 1957 e 1960; v. Dubost e d'Allaines, 1955; v. Dubost e Blondeau, 1957 e 1960; v. Galetti e Brecher, 1962; v. Gammelgard e altri, 1957; v. Gibson, 1954).
È questo lo schema operatorio che abbiamo conservato fino a oggi. Tuttavia durante questi anni nella pratica della circolazione extracorporea sono intervenuti vari miglioramenti tendenti a renderne l'uso più semplice, più efficace e meno pericoloso. Le pompe attuali hanno raggiunto un alto grado di perfezione, che le rende poco traumatizzanti per gli elementi figurati del sangue. Rimane aperta la discussione sui meriti rispettivi del flusso continuo e di quello pulsante; questo, più vicino alla natura, dovrebbe assicurare un funzionamento più armonico di certe zone sensibili dell'organismo.
I miglioramenti di cui sopra riguardano essenzialmente la qualità degli ossigenatori e i nuovi metodi di protezione del miocardio.
b) Gli ossigenatori
Oli ossigenatori sono stati semplificati e i modelli ingombranti e traumatizzanti per gli elementi figurati del sangue sono stati sostituiti da apparecchi monouso, efficienti e poco costosi.
Negli ossigenatori a bolle l'ossigenazione viene assicurata dal gorgogliamento dell'ossigeno all'interno del sangue.
Questi apparecchi, in cui è incorporato anche uno scambiatore termico, coprivano fino a data recente la grande maggioranza dei nostri bisogni. Tuttavia, per affrontare certi problemi si sentiva da tempo la necessità di ossigenatori più elaborati, meno traumatizzanti per il sangue e capaci di assicurare, in caso di necessità, la funzione respiratoria per vari giorni senza indurre alterazioni ematiche (v. Dubost e altri, Premiers..., 1956, 1958 e 1961; v. Dubost e Blondeau, La piace... e 167 interventions..., 1959 e 1960; v. Dubost, Nahas e altri, 1956).
Gli ossigenatori a membrana sembrano in grado di rispondere a queste esigenze. Inizialmente voluminosi e difficili da maneggiare, sono oggi molto semplificati sia nella costruzione che nell'uso. I primi furono realizzati mediante la sovrapposizione di placche sottilissime o anche di pellicole di silicone o di polietilene, perfettamente stagne e abbastanza sottili da garantire l'ossigenazione del sangue senza contatto diretto con l'ambiente gassoso. Recentemente è stato compiuto un passo decisivo con l'impiego delle fibre cave: l'ossigenatore è composto da molte migliaia di tubi a lume microscopico, legati in fasci di 40.000, di lunghezza ridotta e con il diametro complessivo del cilindro di una decina di centimetri. Il tutto è alloggiato in una capsula che contiene lo scambiatore termico. Il passaggio del sangue avviene con facilità all'interno di ogni tubo, con una debole pressione, e l'ossigeno in cui i tubi sono immersi assicura, senza contatto, un'eccellente e atraumatica ossigenazione del sangue. In una versione più recente l'ossigeno percorre le fibre cave immerse nel sangue da ossigenare (v. Bruniaux e altri, 1982; v. Lautier e altri, 1969; v. Nicolas e altri, 1985; v. Suma e Tsuji, 1981).
Questo tipo di ossigenatore è già in commercio: monouso, di prezzo concorrenziale, tende a soppiantare gli ossigenatori a gorgogliamento ed è già oggi di largo uso.
c) La protezione del miocardio
Dall'impiego della perfusione coronarica a cuore pulsante si è arrivati, attraverso varie tappe, fino ai diversi metodi di arresto cardiaco oggi in uso.
La perfusione coronarica, se offre alcuni vantaggi teorici, presta anche il fianco a varie critiche dovute all'ingombro del campo operatorio rappresentato dalle cannule; alla falsa sicurezza di una perfusione delle coronarie non obbligatoriamente estesa a tutte le zone del miocardio; ai rischi secondari di stenosi juxtaostiale in dipendenza dal traumatismo intimale provocato dal palloncino della cannula.
Si possono certo ridurre i rischi e aumentare la comodità dell'intervento con la perfusione discontinua di sangue freddo nel cuore fermo, ma questo non elimina i ripetuti traumatismi degli osti coronarici e i pericoli di dissezione di una coronaria durante l'operazione, che rappresentano fattori di rischio postoperatorio di trombosi coronarica o di stenosi juxtaostiale che si manifesta alcuni mesi dopo.
Il raffreddamento esterno del cuore immerso in un siero ghiacciato, con continuo ricambio, rappresenta certo un metodo meno aggressivo, ma senza dubbio meno efficace per la mancanza di omogeneità nel raffreddamento del miocardio, con conseguente persistenza di rilevanti gradienti termici fra i diversi strati del muscolo cardiaco, in particolare dello strato juxtaendocardico dove possono formarsi zone di necrosi che rendono difficile, se non impossibile, la ripresa della funzionalità cardiaca al termine dell'intervento.
Diversi metodi di ‛cardioplegia chimica' hanno recato un progresso decisivo nella protezione del miocardio. Il loro impiego si riassume nell'inoculazione alla radice dell'aorta di una miscela chimica raffreddata a 10 °C, inoculazione che viene ripetuta ogni trenta minuti. Oggi vengono abitualmente impiegate due tecniche: la cardioplegia cristalloide, a 4 °C di temperatura di iniezione, e la cardioplegia al sangue, a 10 °C di temperatura di iniezione.
Qualunque sia la miscela scelta, viene iniettato nella radice dell'aorta, precedentemente clampata, un litro di miscela in ragione di 250 ml al minuto, con una pressione di 80 mmHg. Ogni trenta minuti vengono iniettati 500 ml supplementari di miscela plegica. Non vogliamo entrare qui nei dettagli dei risultati ottenuti sia sperimentalmente che clinicamente; noi abbiamo scelto la cardioplegia al sangue, che offre diversi vantaggi sulla cardioplegia cristalloide: l'arresto del cuore viene ottenuto in un ambiente ossigenato durante il periodo di attività precedente all'arresto; il cuore è soggetto a periodi di riossigenazione intermittente quando viene ripetuta la cardioplegia; il sangue si oppone alla comparsa dell'edema ischemico ed è tampone migliore del complesso chimico usato nella soluzione cristalloide. Questi dati vengono confermati dall'osservazione di una migliore funzionalità all'atto della ripresa cardiaca e inoltre il numero di infarti del miocardio postoperatori è diminuito in maniera significativa.
Se la cardioplegia ematica rappresenta per noi oggi il sistema d'elezione, rimangono però i rischi coronarici già menzionati, quando un'insufficienza aortica costringa a introdurre la miscela nelle arterie coronarie mediante cannule a palloncino. Dopo aver tentato, e poi abbandonato, l'introduzione attraverso una breve aortotomia di una cannula a palloncino gonfiabile sotto il pavimento aortico, nell'intento di evitare o almeno di ridurre l'insufficienza aortica, abbiamo deciso di usare l'iniezione retrograda della miscela plegica nel seno coronarico, raccomandata da J. N. Fabiani (v. Fabiani e altri, 1982 e 1984).
Le misure termiche rilevate tanto sperimentalmente quanto clinicamente hanno confermato il grado comparabile di raffreddamento del setto interventricolare e delle pareti del cuore, ottenuto sia con l'iniezione anterograda che con quella retrograda. Recentemente è diventato possibile semplificare questo metodo mediante l'iniezione diretta della miscela plegica nella cavità dell'orecchietta destra, dopo clampaggio simultaneo dell'aorta e dell'arteria polmonare. Questa è oggi la tecnica abitualmente usata dalle nostre équipes, ma neppure questo nuovo metodo di introduzione della miscela cardioplegica è riuscito a sopprimere due tipi di complicazioni: le turbe del ritmo, più spesso rilevate dopo la ripresa del battito cardiaco, specialmente nel caso di iniezioni ripetute; il ruolo del freddo come fattore deleterio per la fibra del miocardio. Per quanto si sia avuta notizia di casi di miocardiopatia postoperatoria, allo stato attuale delle conoscenze non è possibile farne risalire la causa all'uso della cardioplegia; resta tuttavia una complicanza possibile, anche se non probabile, sia pure in assenza di qualsiasi lesione coronarica rilevabile con la coronarografia.
d) Il decorso postoperatorio
Così dunque si svolge oggi un intervento condotto in circolazione extracorporea. La durata dell'applicazione e la complessità dei mezzi impiegati, le conseguenze delle alterazioni legate al mantenimento in vita per mezzo della macchina cuore-polmoni, che nonostante i perfezionamenti apportatile è ancora ben lontana dalle condizioni fisiologiche, i disordini emodinamici conseguenti all'arresto circolatorio, oltre che alle eventuali protesi sistemate nelle cavità cardiache, spiegano perché l'operato, dopo che il cuore è stato riattivato in sala operatoria, necessita di varie ore o di qualche giorno di intensa sorveglianza in una unità di cure riservata alle sequele postoperatorie.
Le modeste attrezzature degli inizi sono state sostituite oggi da unità autonome in seno al servizio chirurgico - denominate unità di cure intensive - dove operano équipes di medici specialisti in cardiologia, ma pratici anche di problemi di nefrologia, di neurologia e di pneumologia. L'operato al cuore resta intubato in media per 48 ore e il suo tubo endotracheale è collegato a un respiratore artificiale. Uno schermo elettronico permette il controllo continuo del tracciato elettrocardiografico e dei valori delle pressioni arteriosa e venosa, rilevati da appositi sensori. In caso di necessità può essere registrato anche un encefalogramma. Vengono praticate come norma costante le analisi del sangue che permettono di conoscere la pressione dei gas nel sangue e i principali parametri umorali. È chiaro che questi metodi applicati individualmente a ciascuno degli operati ricoverati nell'unità di rianimazione richiedono la presenza di un personale numeroso e tecnicamente molto preparato. Da qualche tempo alcune unità di rianimazione sono state dotate di un sistema di sorveglianza computerizzata, per il quale occorre prestabilire una tabella di dati e una di decisioni: la prima permette di analizzare i differenti parametri di sorveglianza, la seconda di prendere, sulla base di questi parametri, certe decisioni terapeutiche automatiche (v. rianimazione).
e) La riattivazione cardiaca in sala di rianimazione
L'arresto cardiaco inopinato in un operato con tubo endotracheale e ventilazione artificiale costituisce un incidente che richiede la rapidissima messa in opera di mezzi atti a richiamarlo in vita in uno spazio di tempo inferiore a tre minuti, pena l'insorgere di lesioni cerebrali da anossia rapidamente irreversibili. Dato l'allarme, si sostituisce la ventilazione automatica con quella manuale e si inizia il massaggio cardiaco esterno. Si somministrano farmaci antiacidi e, dopo qualche minuto di massaggio, si tenta la defibrillazione per shock esterno. Il risultato viene valutato in base al tracciato elettrocardiografico: può essere positivo e restare tale fin dal primo shock, ma in altri casi saranno necessari periodi di massaggio ripetuti, alternati a tentativi di defibrillazione; in altri, infine, i tentativi saranno vani, essendo le cause dell'arresto cardiaco non soltanto metaboliche, ma legate a una complicazione anatomica (embolo coronarico, trombosi delle valvole, ecc.). Se l'arresto cardiaco sopravviene fuori dall'unità di rianimazione, la prognosi è più grave, perché i tempi occorrenti per la messa in opera di una ventilazione respiratoria associata al massaggio cardiaco superano facilmente i fatidici tre minuti.
3. Le cardiopatie congenite
Il complesso delle cardiopatie congenite può essere suddiviso in due grandi gruppi, secondo che siano accompagnate o no da cianosi. Il gruppo non accompagnato da cianosi è caratterizzato da un cortocircuito arterovenoso (shunt sinistra-destra), per cui il sangue ossigenato passa ad arricchire il sangue venoso desaturato; il gruppo accompagnato da cianosi è caratterizzato da un cortocircuito venosoarterioso (shunt destra-sinistra) causato da una stenosi dell'orifizio polmonare: il sangue ossigenato viene desaturato per miscela con una quantità più o meno rilevante di sangue venoso.
a) Le cardiopatie congenite non cianogene
Sono queste, naturalmente, quelle che per prime furono suscettibili di essere trattate chirurgicamente (v. Donzelot e d'Allaines, 1953), ma ci soffermeremo su di esse solo per accennare brevemente ad alcuni punti caratteristici.
La comunicazione interatriale banale, tipo ostium secundum, rappresenta la maggior parte dei casi operati: chiusa quasi sempre per sutura diretta, offre alla grande maggioranza dei malati una guarigione definitiva. Tuttavia le forme a localizzazione bassa, juxtacava inferiore, richiedono una cura particolare nella chiusura per evitare il restringimento dell'ostio della vena cava o anche la sua trasposizione verso l'atrio sinistro (v. Blondeau e altri, 1975; v. Dubost e altri, 1964).
Lo sbocco anomalo parziale delle vene polmonari associato non solleva difficoltà particolari: un piccolo lembo di tessuto cucito davanti alle vene polmonari è sufficiente, chiudendo la comunicazione, a dirigere il sangue polmonare verso l'orecchietta sinistra.
L'ostium primum è una lesione meno frequente, che riveste interesse per la quasi costante associazione con una fenditura della grande valvola mitrale e una malformazione profonda della valvola tricuspide settale. La riparazione è più complessa e più delicata, esposta inoltre al rischio di provocare un blocco atrioventricolare.
La comunicazione interventricolare è molto meno frequente dell'ostium secundum. Nella forma minore, malattia di Roger, l'indicazione dell'intervento chirurgico è messa in discussione e, pare, può essere conservata solo nell'eventualità di un innesto osleriano. In altri casi uno scambio di sangue molto rilevante, un'ipertensione polmonare insorgente o già consolidata, segni di sofferenza cardiaca sono argomenti che possono indurre a raccomandare l'intervento. Questo mette spesso in luce comunicazioni localizzate in alto, nella parte membranosa, di dimensioni variabili, che sono chiuse di solito con un lembo di tessuto. Ma la lesione può anche essere situata molto indietro, nascosta dalla tricuspide, o in pieno setto muscolare, e ogni varietà richiede tecniche di chiusura particolari. L'operazione è assai delicata ed espone a rischi di chiusura incompleta (le comunicazioni a forma di anello da chiavi mostrano particolare predisposizione a questo difetto) e di blocchi atrioventricolari, a cui sono particolarmente esposte le forme accompagnate da ipertensione polmonare. Le forme a pressione sistemica e polmonare uguali, senza interscambio di sangue o con scambio rovesciato, non devono essere operate (v. Dubost, Blondeau e altri, 1956; v. Soyer e altri, 1975).
Le altre cardiopatie congenite a cortocircuito arterovenoso (shunt sinistra-destra) rappresentano quasi delle rarità, di cui però non si deve trascurare l'interesse, dato che molte si prestano a interventi chirurgici curativi. Si tratta di fistole coronarocardiache, della rottura di aneurismi del seno di Valsalva, di comunicazioni aortopolmonari che hanno in comune, all'auscultazione, un soffio continuo e al cateterismo rivelano uno shunt sinistra-destra a vario livello e di varia importanza. Si raccomanda l'intervento chirurgico per tutte queste cardiopatie anche nel corso del quinto, sesto e settimo decennio. Più avanti parleremo del caso particolare della comunicazione interventricolare del lattante, che può esigere un intervento anche nei primissimi periodi della vita.
Ultime voci, infine, la persistenza del dotto arterioso e la coartazione dell'aorta, collocate un po' abusivamente nel gruppo delle cardiopatie perché riguardano i vasi endotoracici e l'intervento si basa su tecniche affini.
La soppressione della persistenza del dotto arterioso richiede un intervento tutt'altro che facile, specialmente se il dotto è infetto o vi è ipertensione polmonare. Oggi sappiamo che bisogna sempre sezionare completamente il canale e suturarne le due estremità. I casi di recidiva sono provocati da canali legati in cui il filo non è stato stretto a sufficienza oppure ha provocato il taglio parziale della parete. I reinterventi sono oggi effettuati con minore rischio ricorrendo al cuore-polmoni artificiale (v. Gross e Hubbard, 1939).
Le migliaia di casi operati per curare la coartazione dell'aorta ci permettono di conoscere a fondo i rischi dell'intervento e di estenderne l'indicazione dall'età neonatale fino al sesto decennio: la sola questione importante è sapere se la cura della malformazione ha un'influenza favorevole e costante sull'ipertensione arteriosa. I controlli da noi intrapresi ci permettono di rispondere affermativamente nella grande maggioranza dei casi, e ci orientano a consigliare l'intervento intorno al nono o al decimo anno (v. Crafoord e Nylin, 1945; v. Dubost e altri, La coarctation..., 1968).
b) Le cardiopatie congenite cianogene
1. Tetralogia di Fallot. - I quattro elementi che caratterizzano la tetralogia, descritti da E. L. A. Fallot nel secolo scorso (v. Fallot, 1888), sono: la comunicazione interventricolare; la stenosi della via polmonare; l'aorta destroposita, a cavallo del setto interventricolare; l'ipertrofla del ventricolo destro. Da quando Blalock propose, nel 1944, l'anastomosi fra le arterie succlavia e polmonare sono stati compiuti progressi continui e oggi questa malattia, che rimane la più frequente fra le cardiopatie cianogene, è anche quella di cui più spesso si può effettuare la cura radicale nelle migliori condizioni, con risultati che si mantengono favorevoli nel tempo anche dopo oltre venticinque anni (v. Dubost e altri, 1948; v. Dubost, 1962 e 1964).
La forma media della tetralogia dei bambini e degli adolescenti, dopo i primi interventi, ha visto diminuire regolarmente i rischi operatori, oggi valutati intorno al 5%. Il rimedio è costituito dalla chiusura mediante protesi dell'ampia comunicazione interventricolare, dalla ricostruzione della cavità del ventricolo destro e dall'allargamento delle valvole polmonari stenotiche. I risultati sono eccellenti e si mantengono nel tempo, come è stato verificato da uno studio sistematico da noi condotto sui sopravvissuti fra i 900 operati che costituiscono l'esperienza complessiva dell'ospedale di Broussais, sui quali pratichiamo cateterismo e angiografia di controllo. Invece gli esiti operatori sono meno uniformemente buoni e duraturi in quei pazienti in cui si è dovuto allargare, innestando un vasto lembo di tessuto, la via infundibulo-polmonare: l'insufficienza polmonare che ne consegue danneggia la qualità del risultato funzionale. Questa complicazione, che può diventare abbastanza grave, ha indotto alcune équipes a proporre l'impianto sistematico di una valvola artificiale in posizione polmonare nei casi in cui si presenta la necessità di allargare in modo sensibile la regione infundibulo-polmonare; ma ciò porta in primo piano gli inconvenienti a lungo termine della protesi. Una nuova arma tattica ha permesso di risolvere il problema dei tronchi atresici della tetralogia di Fallot: il tubo di Hancock fornito di un eteroinnesto, che permette di creare un'anastomosi fra ventricolo destro e biforcazione polmonare e di ripristinare condizioni emodinamiche soddisfacenti. Anche in questo caso la funzionalità nel tempo dell'eteroinnesto è uno dei problemi da affrontare nella valutazione dei risultati a distanza.
Restano le forme che hanno subito un intervento preliminare palliativo: la soppressione dell'anastomosi terminolaterale di Blalock non pone quasi alcun problema, mentre quella termino-terminale, l'anastomosi di Waterston e soprattutto l'operazione di Potts, o anastomosi cava-polmonare, complicano notevolmente l'operazione e ne accrescono i rischi. Per fortuna, almeno nella nostra esperienza, l'anastomosi termino-laterale di Blalock ha sempre avuto la preferenza, mentre le altre operazioni, compresa quella di Potts, non sono state eseguite se non occasionalmente (v. Potts e altri, 1946; v. Waterston, 1962).
La correzione della tetralogia di Fallot può essere eseguita attraverso l'orecchietta destra, con una tecnica preconizzata da Edmunds e Binet, che offre il vantaggio di rispettare il ventricolo destro e di assicurare migliori risultati sotto l'aspetto emodinamico (v. Binet e altri, 1983; v. Dubost e altri, L'abord..., 1968 e Résultats..., 1980; v. Dubost e Carpentier, 1980; v. Fallot, 1888; v. Lillehei e altri, 1955).
2. La trasposizione completa dei grandi vasi
Questa malformazione si colloca a un livello di frequenza assai elevato fra le cardiopatie congenite cianogene: secondo le statistiche se ne riscontrano 5-7 casi su mille nascite, ed è una delle più gravi, perché la caratteristica discordanza fra ventricoli e arterie non permette la sopravvivenza alla nascita, quando si chiudono il dotto arterioso e la comunicazione interauricolare che permettevano al sangue di mescolarsi durante la vita fetale. Infatti, il ventricolo sinistro che riceve il sangue ossigenato lo invia all'arteria polmonare, mentre il ventricolo destro che riceve il sangue desaturato lo invia all'aorta: soltanto una comunicazione fra le due orecchiette o fra i due ventricoli, che permetta al sangue di mescolarsi, garantisce al neonato una precaria sopravvivenza.
Dal 1950 sono stati proposti in continuazione nuovi interventi palliativi destinati a permettere la miscela del sangue in quei neonati che non presentano comunicazioni intercavitarie.
In questo campo l'operazione di Blalock-Hanlon, che consiste nel creare una vasta comunicazione interatriale senza ricorrere alla circolazione extracorporea, ha goduto di un certo favore. Poco tempo dopo Rashkind apportò un'innovazione tecnica molto importante, che agevola la creazione di una comunicazione interatriale: si introduce per via venosa una sonda a palloncino gonfiabile, fino all'atrio sinistro, forzando la valvola della fossa ovale; a questo punto si gonfia il palloncino e si ritira a forza la sonda, creando così una comunicazione della dimensione del palloncino. Questo procedimento ha soppiantato completamente l'operazione di Blalock-Hanlon perché consente, con un metodo puramente medico, di far sopravvivere alcuni bambini per il tempo sufficiente a permettere loro di affrontare l'intervento correttivo (v. Glenn e Patino, 1954; v. Rashkind e Miller, 1968).
Fin dal principio alle équipes specializzate in chirurgia delle cardiopatie congenite, e ben presto anche a quelle che si occupano delle malattie neonatali, parve evidente che la soluzione ideale del problema della trasposizione dei vasi fosse correggere la discordanza ventricolo-arteriosa e rimettere in comunicazione diretta il ventricolo sinistro con l'aorta e il ventricolo destro con l'arteria polmonare, eliminando la o le coesistenti comunicazioni intercavitarie. Lo scoglio rappresentato dall'origine delle coronarie ha ritardato la scoperta della soluzione fino ad anni recenti.
Nel frattempo hanno conosciuto grande favore due modalità operatorie palliative.
L'intervento di Mustard, dal nome del chirurgo canadese che lo propose nel 1964, consiste nella creazione di una sorta di canale, di tessuto pericardico o di dacron, cucito entro la cavità delle orecchiette rese ampiamente comunicanti mediante la resezione del setto che le separa, in modo che il sangue proveniente dalle due vene cave viene diretto verso il ventricolo sinistro e poi nell'arteria polmonare, mentre il sangue proveniente dalle vene polmonari raggiunge il ventricolo destro e di qui l'aorta.
Questa tecnica presenta tre inconvenienti:
1) la possibilità che compaiano alterazioni nel ritmo cardiaco di origine atriale, che possono provocare la morte per fibrillazione;
2) la possibilità di retrazione della protesi, che provoca la stenosi dell'orifizio delle vene cave o delle vene polmonari;
3) i rischi di cedimento del ventricolo destro, divenuto ventricolo sistemico e non attrezzato per questo lavoro; inoltre la valvola ventricolo-auricolare tricuspide, che svolge le funzioni di quella mitrale, può diventare insufficiente a causa dell'alta pressione che regna in questo ventricolo al momento della sistole (v. Mustard, 1964).
L'intervento di Senning, dal nome del chirurgo svedese che lo ideò nel 1959, è più difficile da descrivere che da eseguire: un lembo del setto che separa le orecchiette viene cucito in modo tale che il sangue delle vene polmonari non abbia altra via di uscita che il ventricolo aortico. Poi il labbro inferiore dell'incisione dell'orecchietta destra viene suturato con la porzione inferiore residua del setto interauricolare, obbligando così il sangue nero delle vene cave a raggiungere il ventricolo sinistro e poi il polmone. La chiusura dell'orecchietta destra è assicurata dalla sutura del labbro superiore dell'incisione ingrandito da un lembo di pericardio autologo, dietro gli orifizi delle vene polmonari (v. Senning, 1959).
Anche in questo tipo di intervento sono da temere le turbe postoperatorie del ritmo cardiaco e la disfunzione del ventricolo destro e della corrispondente valvola tricuspide, sottoposti al regime di pressione sistemica.
Oggi questi due tipi di intervento (anche se il secondo ha conosciuto, entro certi limiti, un rinnovato favore in questi ultimi anni) sono stati progressivamente abbandonati a vantaggio della correzione completa della malformazione, ottenuta eliminando la trasposizione fra aorta e arteria polmonare. Il primo passo su questa strada è stato compiuto da A. D. Jatene, di San Paolo, che nel 1975, scegliendo lattanti portatori di trasposizione associata a una larga comunicazione interventricolare e perciò con pressione uguale nei due ventricoli, tagliava anularmente l'aorta intorno alle arterie coronarie e la suturava sul moncone dell'arteria polmonare all'uscita dal ventricolo sinistro. Ma per riportare l'arteria polmonare sul moncone aortico occorreva l'innesto di un tubo di plastica per ovviare alla lunghezza insufficiente del tronco polmonare; questo tubo, di piccolo diametro per adattarsi alle dimensioni di un lattante di qualche mese, dava presto luogo a complicazioni (v. Jatene e altri, 1975).
Il francese Y. Lecompte ha recentemente risolto questo problema sciogliendo l'incrocio fra aorta e arteria polmonare, in modo che la biforcazione polmonare venga a collocarsi davanti all'aorta, rendendo così disponibile una lunghezza maggiore che permette la sutura ‛diretta' del tronco polmonare sul moncone aortico (v. Lecompte e altri, 1982).
Rimane il problema delle trasposizioni che associano a una comunicazione interventricolare una stenosi delle valvole polmonari. A partire dal 1970 G. C. Rastelli, operando alla Mayo Clinic, propose di utilizzare un tubo di plastica munito di valvola, da collocare fra ventricolo polmonare e arteria polmonare, previa realizzazione di uno sbarramento intraventricolare mediante un lembo che diriga il sangue del ventricolo sinistro verso l'aorta attraverso la comunicazione interventricolare. Questa operazione ha conosciuto e conosce ancora grande favore, nonostante gli inconvenienti a cui vanno soggetti il tubo e la bioprotesi che contiene.
Gli attuali tentativi fatti da Lecompte per evitare l'innesto di un tubo munito di valvola sono troppo recenti perché se ne possano trarre conclusioni: certamente, comunque, i prossimi anni vedranno la riuscita completa e definitiva delle operazioni radicali nella cura della trasposizione dei grandi vasi (v. Binet e altri, 1972; v. Rastelli e altri, 1969).
A fianco di questi due grandi gruppi, che rappresentano la maggioranza delle cardiopatie cianogene, altre varietà hanno sollecitato lo spirito inventivo dei chirurghi e, da poco, hanno dato origine a tentativi di correzione.
Il tronco arterioso può oggi essere trattato chiudendo la comunicazione interventricolare e innestando un tubo dotato di eteroinnesto tra ventricolo destro e arteria polmonare (Rastelli). I risultati dell'intervento dipendono dal tipo anatomico della malformazione e dal grado delle resistenze vascolari polmonari. A lungo termine compaiono anche qui gli inconvenienti dovuti al tubo e alla sua valvola.
L'atresia della tricuspide oggi beneficia dell'operazione di Fontan modificata e semplificata con una semplice anastomosi atriopolmonare e la chiusura della comunicazione interventricolare, senza interposizione di valvola (v. Björk e altri, 1979; v. Doty e altri, 1981; v. Fontan, 1977; v. Fontan e altri, 1971, 1977 e 1980; v. Fontan e Choussat, 1975; v. Lacorte e altri, 1975).
Il ventricolo unico beneficia oggi, piuttosto che della rischiosa creazione del setto, della diversione atriopolmonare diretta, combinata con la chiusura mediante riporto di un lembo di tessuto dell'orifizio della tricuspide e con la sutura dell'orifizio polmonare stenotico (v. Dubost e altri, Réparation..., 1975; v. Dubost e Chauvaud, 1983).
Il ventricolo destro a doppia uscita rappresenta una malformazione complessa, le cui difficoltà di correzione dipendono sia dalla posizione delle grandi arterie sia dalla sede della comunicazione interventricolare. Nel caso di situs solitus, con aorta a sinistra e comunicazione interventricolare ampia, in posizione subaortica, è possibile realizzare un canale interventricolare che, chiudendo la comunicazione, diriga il sangue del ventricolo sinistro nell'aorta; il lembo riportato verrà messo in opera dopo che sia stata resecata la stenosi infundibulare polmonare associata.
Anche le altre cardiopatie cianogene possono essere corrette, ma creano maggiori difficoltà tecniche e offrono minori probabilità di riuscita.
Le discordanze atrioventricolari, già spesso interessate da una dissociazione atrioventricolare idiopatica, si prestano a una fine chirurgia riparatrice (v. Dubost e altri, Traitement..., 1980).
La sindrome di Ebstein, a sua volta, può essere trattata con la plicatura ventricolare associata alla messa in opera di una protesi in posizione tricuspide sopracoronarica, che rimedia alla disfunzione cardiaca (v. Dubost e altri, Correction..., 1968).
Se a questa lunga lista si aggiunge il successo abituale delle operazioni per il trattamento della stenosi polmonare (in cui la dilatazione mediante sonda a palloncino gonfiabile è diventata il metodo ideale di trattamento delle varietà valvolari isolate) o aortica, valvolare o infundibulare, si sarà completato il panorama delle cardiopatie congenite e dimostrato che esse sono, per la maggior parte, riparabili in buone condizioni, e molte anche in maniera completa e definitiva.
c) La chirurgia del lattante
In questi ultimi anni si è sviluppata, principalmente negli Stati Uniti ma poi anche in Europa, una forte corrente ispirata ai lavori dei giapponesi che tende a raccomandare l'attacco chirurgico di certe cardiopatie congenite nel neonato e nel lattante (v. Binet e altri, 1980 e 1981; v. Binet, 1981).
I nuovi mezzi perfezionati impiegati per operare il cuore (ipotermia profonda, ossigenatore a membrana) sono stati applicati al lattante per curare cardiopatie che fino a poco tempo fa erano mortali nelle prime settimane o nei primi mesi di vita: comunicazioni interventricolari con ipertensione polmonare, trasposizioni complete mal tollerate, canali atrioventricolari comuni completi, per citare gli esempi più frequenti. Perfino certe forme mal tollerate della tetralogia di Fallot possono essere corrette subito nei primi mesi di vita.
Si tratta senza dubbio di un'acquisizione importante quando la si applica a certe malformazioni complesse, mal tollerate fin dalla nascita, o che espongono al rischio potenziale di un aumento delle resistenze polmonari che, col tempo, renderebbe vano qualunque intervento: è ciò che avviene in certe forme di tronco arterioso, di canale atrioventricolare completo e in certe comunicazioni interventricolari con cospicuo scambio di sangue accompagnato da insufficienza cardiaca difficilmente controllabile.
Abbiamo già parlato dell'evoluzione delle idee e delle tecniche in favore della riparazione completa precoce della trasposizione dei grandi vasi. In altri casi, in particolare nella tetralogia di Fallot, siamo rimasti fedeli all'anastomosi palliativa preventiva di Blalock, che permette di attendere che il bambino abbia raggiunto il peso di una decina di chili prima di sottoporlo a intervento radicale.
4. Le cardiopatie acquisite
Le malattie delle valvole cardiache, aortica, mitrale e tricuspide (stranamente la polmonare non è mai interessata), rappresentavano fino a poco tempo fa il gruppo principale delle cardiopatie acquisite che presentavano possibilità di interventi chirurgici, grazie ai progressi registrati negli ultimi trent'anni nel campo della diagnostica e al sorgere di nuove modalità terapeutiche (v. d'Allaines e altri, Rétrécissement..., 1949).
Quindici anni fa nasceva la chirurgia delle arterie coronarie, che ha avuto un tale sviluppo da relegare ben presto in secondo piano la chirurgia valvolare, aiutata in questo dalla diminuzione dei portatori di valvulopatie, dovuta alla scomparsa della febbre reumatica, causa prima dell'alterazione delle valvole cardiache: scomparsa quasi totale nel Nordeuropa, ma non ancora completa nell'ambito mediterraneo, in Africa, nell'America Centrale e Meridionale.
Le miocardiopatie rappresentano un terzo gruppo di malattie, in cui però la chirurgia svolge un ruolo meno importante.
a) Le malattie delle valvole cardiache.
1. Chirurgia radicale
La creazione delle valvole artificiali, realizzate nel 1960 negli Stati Uniti, ha profondamente mutato l'impostazione terapeutica delle malattie delle valvole cardiache. Le valvole artificiali sono di due tipi: meccaniche e biologiche (o bioprotesi).
Le valvole meccaniche sono state create per prime, e fra esse resta celebre quella di Starr, dal nome del chirurgo che la realizzò e l'applicò nell'uomo nel 1961. Si tratta di una valvola a biglia di silastic, che si muove entro una gabbia costituita da tre o quattro sbarrette metalliche, con la sede rigida rivestita di dacron in modo da permetterne la fissazione per sutura. Al primo modello sono stati apportati vari miglioramenti successivi, che non sono riusciti però a sopprimere la complicazione essenziale di questo tipo di protesi, cioè la formazione di coaguli che provocano emboli. Malgrado le caratteristiche meccaniche molto favorevoli, dimostrate su acceleratore, questo tipo di valvola - in pratica inconsumabile - non ha ancora raggiunto il grado di sicurezza richiesto. La valvola di Smeloff-Cutter a doppia gabbia, dello stesso tipo, in posizione aortica offre prestazioni meccaniche altrettanto buone e soprattutto garantisce una sicurezza maggiore contro i rischi trombo-embolici.
Le valvole a disco (valvole a disco unico di Björk o a disco doppio di Saint Jude, in cui il pirolato di carbonio sembrava promettere una perfetta emocompatibilità) rappresentano un'alternativa che per un certo periodo è sembrata tale da detronizzare le valvole a biglia. Le speranze però sono andate deluse e la funzionalità di questo tipo di valvola non si è dimostrata superiore a quella delle valvole a biglia (v. Dubost e altri, Replacement..., 1966 e Résultats.., 1973; v. Sanfelipo e altri, 1976; v. Starr e altri, 1976; v. Starr ed Edwards, 1961).
Le bioprotesi sono nate dall'idea di D. Ross (1963) di utilizzare un omoinnesto come materiale ideale per la sostituzione delle valvole cardiache. Il metodo era affascinante solo in apparenza, perché si prestava a impianti solo in posizione aortica e soprattutto perché il reperimento delle parti da innestare poneva problemi quasi insolubili; inoltre l'uso esponeva alle normali complicazioni degli omoinnesti, spesso soggetti a rigetto da parte dell'ospite. Per questi motivi il metodo fu difeso quasi solo dal suo inventore (v. Barrat-Boyes e altri, 1965; v. Ross, 1964).
L'idea di utilizzare non più un omoinnesto ma un eteroinnesto (di porco, di vitello) fu difesa fin dal 1965 dall'équipe di J. P. Binet, C. Duran e A. Carpentier, ma all'inizio senza successo; si dovette attendere il 1968 e il trattamento delle valvole con aldeide glutarica, proposto da Carpentier, perché l'eteroinnesto entrasse a far parte dell'arsenale terapeutico.
La valvola prelevata dal maiale viene sottoposta al trattamento chimico e poi suturata in una cornice circolare che ne facilita l'inserzione oltreché la funzionalità emodinamica. Questa cornice inoltre protegge la valvola dalla penetrazione di cellule provenienti dall'ospite. Così preparate e trattate chimicamente, queste valvole non sono più innesti in senso stretto perché, a differenza da questi, la loro durata non dipende dalla sostituzione delle loro cellule con quelle dell'organismo ospite ma dalla tolleranza, dalla stabilità e dalla resistenza del tessuto valvolare. Per eliminare questo equivoco è stato introdotto il termine di bioprotesi. Durante gli ultimi quindici anni queste valvole sono state largamente impiegate in posizione mitralica, meno spesso in posizione aortica o tricuspidale. I risultati sono favorevoli soprattutto per quanto riguarda la posizione mitralica, in cui la bioprotesi sembra la scelta migliore. In effetti il vantaggio fondamentale di questo tipo di valvole sta nel fatto che può liberare il malato dalla dipendenza permanente dagli anticoagulanti; questo fatto è importante per esempio tanto per le giovani donne che desiderano diventare madri, quanto per il malato anziano esposto ai rischi di un lungo uso degli anticoagulanti. Però anche la bioprotesi offre il fianco alle critiche. Innanzitutto questa protesi è mal tollerata dal bambino, in cui la valvola si ispessisce, subisce una degenerazione fibrosa o anche si calcifica in modo massiccio, spesso molto rapidamente, qualche mese dopo l'impianto, specie in posizione mitralica; in secondo luogo, la protesi non dura in media più di dieci anni, al termine dei quali deve essere sostituita.
Queste ragioni sono sembrate sufficienti per la scelta di altri tessuti animali per fabbricare, copiando la natura, valvole simili a quelle usate precedentemente (v. Binet e altri, Implantation... e Heterologous..., 1965, 1966, 1968; v. Binet, 1968; v. Camilleri e altri, 1982; v. Carpentier e altri, Utilisation... e Remplacement..., 1967, 1968, 1969, Utilisation... e Collagen-derived..., 1971, Six years... e Biopolymers..., 1974, 1981, 1982, 1984; v. Carpentier, 1971, 1977, e Hétérogreffes..., 1981; v. S. Carpentier, 1983; v. Deloche e altri, 1983; v. Dubost e altri, À propos..., 1975).
È possibile, infine, utilizzare valvole in pericardio animale, poiché sembra che il pericardio non sia soggetto alle principali controindicazioni valide per gli eteroinnesti, in particolare per quanto riguarda i piccoli diametri aortici o mitrali: ciascuna delle tre valvole, trattata con glutaraldeide e tagliata nella misura richiesta, viene suturata entro un anello rivestito di teflon adatto alla sutura. Già molte di queste valvole sono state impiantate nell'uomo, ma troppo recentemente perché sia permesso Sostenere che questo tipo di protesi ha soppiantato tutti gli altri. Comunque, molte équipes le hanno scelte soprattutto per gli interventi sull'aorta e sulla tricuspide.
2. Chirurgia di conservazione
L'incertezza sull'affidabilità delle protesi, sia meccaniche sia biologiche, induce i chirurghi a proseguire i tentativi correttivi, soprattutto per quanto riguarda la mitrale e la tricuspide. L'orifizio aortico difatti, salvo certe stenosi per lo più congenite, non si presta bene alla chirurgia di conservazione. Invece la mitrale, per la grande varietà delle sue lesioni anatomiche e anche, come abbiamo già detto, per i rischi derivanti dalle attuali protesi, ha dato luogo a moltissime ricerche (v. Carpentier e altri, Surgical..., 1974; v. Dubost e altri, 1977; v. Judgutt e altri, 1977; v. Sanfelipo e altri, 1976).
Dopo i primi tentativi di Kay, Merendino e Wooler, che fin dall'inizio proposero e realizzarono la riduzione della parte posteriore dell'anello mitralico, la sola dilatata, con una anuloplastica asimmetrica, sono state adottate molte altre tecniche per affrontare le insufficienze mitraliche dovute a ditatazione dell'anello. Una delle più diffuse, ideata da Carpentier, deriva dallo stesso principio di anuloplastica asimmetrica e consiste nell'impianto, a livello dell'anello mitralico, di un anello metallico rivestito ditefion, che consente di conservare l'intera superficie del grande lembo valvolare, mentre la parte posteriore dilatata dell'anello mitralico, che corrisponde all'inserzione del piccolo lembo valvolare, viene raccorciata mediante punti di sutura ravvicinati che la arricciano. Questa tecnica ha trovato largo impiego a livello della tricuspide, particolarmente per le insufficienze funzionali spesso associate alle lesioni organiche della mitrale. Data l'esistenza su questo orifizio di tre lembi valvolari, viene usato un anello di forma speciale che permette di ridurre la parte anteriore dilatata dell'anello tricuspidale, mentre conserva intatta la dimensione della parte posteriore (v. Carpentier, 1969; v. Carpentier e altri, A new..., 1971 e 1980; v. Chauvaud e Carpentier, 1980; v. Deloche e altri, Annuloplastie..., 1975 e 1980; v. Dubost e altri, Nouvelle..., 1966, La chirurgie..., 1971 e À propos..., 1975; v. Grondin e altri, 1975; v. Hanania e altri, 1973; v. Kay ed Egerton, 1963; v. Kay e altri, 1965; v. Merendino e altri, 1959; v. Wooler e altri, 1962).
La chirurgia di conservazione della mitrale non si limita all'uso dell'anello di Carpentier. Infatti l'apparato valvolare mitralico è spesso affetto da lesioni che provocano stenosi (restringimento della mitrale) o miste, che provocano sia stenosi sia insufficienza (malattia mitralica). In queste diverse varietà l'apparato di sospensione della valvola (muscoli papillari e corde tendinee) può risultare alterato e, quando le lesioni non siano troppo profonde e diffuse, è giustificato un tentativo di chirurgia di ricostruzione.
Oggi la maggioranza delle équipes mediche si dichiara a favore della chirurgia a cuore aperto per tutte le varietà di lesioni mitraliche. Da parte nostra continuiamo a preferire per un piccolo gruppo di malattie particolari (stenosi mitralica pura, a cuore piccolo, con ritmo sinusale) la chirurgia a cuore chiuso, che sosteniamo dal 1952 e che consiste nel dilatare la stenosi per mezzo di un dilatatore speciale introdotto attraverso l'orecchietta; centinaia di malati sono stati operati con questa tecnica con buoni risultati che si mantengono per oltre 25 anni. Certo, la commissurotomia mitralica a cuore aperto consente una migliore apertura delle commissure e permette anche di intervenire sull'apparato di sospensione della valvola quando ciò è imposto da un ispessimento e da un raccorciamento delle corde tendinee. Resta però il problema della durata di questi miglioramenti (il reumatismo cardiaco è una malattia evolutiva) e anche la possibilità che la vista della lesione induca il chirurgo a illegittime o abusive sostituzioni delle valvole (v. d'Allaines e altri, 1953; v. Dubost, 1955; v. Dubost e altri, 1954).
Per concludere, migliaia di malati sono stati operati per malattie delle valvole cardiache, interessanti a volte una sola valvola, a volte anche due o tre; le protesi valvolari sono tuttora al primo posto, ma alle valvole meccaniche, principalmente quelle a biglia, si tende a sostituire, almeno in posizione mitrale, gli eteroinnesti. C'è poi un notevole numero di malati che subiscono operazioni conservative, specialmente per le dilatazioni idiopatiche dell'anello valvolare e per le rotture delle corde tendinee.
b) Le miocardiopatie
Sono costituite da un gruppo di malattie del muscolo cardiaco derivanti da cause sconosciute. La distinzione fra miocardiopatie primitive e secondarie è stata oggi abbandonata perché quest'ultimo gruppo è stato assegnato al campo delle malattie specifiche del muscolo cardiaco.
Le miocardiopatie si distinguono in tre varietà: congestiva, ipertrofica e restrittiva.
Miocardiopatia congestiva. - È presente in tutte le etnie ma non è possibile precisarne la frequenza esatta, probabilmente di circa 20 malati per 100.000 abitanti.
Si manifesta con segni di insufficienza della mitrale e della triscupide e con una concomitante diminuzione del flusso cardiaco e della frazione di eiezione, associata all'aumento della pressione telediastolica del ventricolo sinistro. L'esame angiocardiografico rivela la dilatazione dei ventricoli con ipocinesia globale, riflusso mitralico e fegato da stasi. Alla coronarografia le arterie coronarie sono normali.
La biopsia endomiocardica rivela un ispessimento dell'endocardio, con trombosi nel 50% dei casi, l'aumento del tessuto fibroso, senza alterazioni istologiche specifiche, e arteriole coronarie normali.
Il trattamento medico è analogo a quello di tutte le forme di insufficienza cardiaca congestizia, mentre la chirurgia non ha indicazioni nel trattamento di questa malattia, salvo nelle forme estreme per cui può essere presa in considerazione l'utilità del trapianto cardiaco.
Miocardiopatia ipertrofica. - Anche in questo caso la frequenza reale della malattia è sconosciuta; essa è comune in Giappone, ma eccezionale nella razza nera.
La conoscenza di precedenti familiari associati con angor e/o con episodi di sincope può orientare verso la ricerca di un soffio sistolico puntale, cui si accompagnano alterazioni quasi specifiche del tracciato elettrocardiografico. All'indagine radiografica il cuore si rivela di volume aumentato; il cateterismo cardiaco dà risultati variabili di giorno in giorno nello stesso malato; il gradiente ventricolo-aortico può mancare o rivelarsi modesto anche in forme clinicamente gravi. L'angiocardiografia e l'ecocardiografia confermano i dati clinici e soprattutto permettono di precisare il grado dell'insufficienza mitralica associata. La biopsia endoventricolare mostra una disorganizzazione delle fibre muscolari ipertrofiche, con noduli di forma bizzarra e sviluppo di fibrosi interfibrillare. Il trattamento è essenzialmente medico e i betabloccanti hanno azione positiva nel 70% dei casi. La chirurgia trova indicazione solo nelle forme in cui l'insufficienza mitralica assume un ruolo preminente e impone la sostituzione della valvola con una protesi, oppure nei rari casi di fallimento delle cure mediche quando può essere presa in considerazione l'esecuzione di una miectomia endoventricolare.
Miocardiopatia restrittiva
Rappresenta la terza e ultima varietà delle malattie primitive del miocardio. Descritta da Loeffier nel 1936, consiste in una fibrosi endocardica mono- o biventricolare, con insufficienza delle valvole mitrale e tricuspide dovuta alla retrazione fibrosa degli apparati valvolari e dei tessuti stessi delle valvole. Causa di adiastolia (insufficiente riempimento del o dei ventricoli), è caratterizzata dall'evoluzione verso l'insufficienza cardiaca che conduce più o meno rapidamente alla morte. Il cateterismo cardiaco, l'ecocardiografia e l'angiocardiografia consentono di precisare le caratteristiche emodinamiche della malattia.
Questa evoluzione inesorabile verso la morte ci ha indotti a prendere in considerazione la possibilità di una nuova operazione, che consiste nella decorticazione dell'endocardio colpito da fibrosi, con sostituzione delle valvole atrioventricolari. Abbiamo realizzato questa operazione per la prima volta nel 1971 e il paziente si è mantenuto in buona salute per otto anni. Pare perciò che questa nuova possibilità chirurgica sia suscettibile di applicazione in molti malati prima condannati.
Questa endocardite fibrosa è rara in Europa, ma diffusa in certe regioni equatoriali, specialmente nella Costa d'Avorio, dove costituisce la più frequente causa di morte di origine cardiaca in età giovanile. Anche il nordest del Brasile e il sud dell'India sono regioni in cui è diffusa questa malattia, la cui eziologia rimane sconosciuta. Studi recenti hanno messo in luce il ruolo dell'ipereosinofilia nella genesi dell'attacco all'endocardio, fase acuta a cui succede una fase cronica di cicatrizzazione e di retrazione (v. Dubost e altri, Endocardite..., 1973, 1976 e Surgical..., 1981; v. Loeffier, 1936).
5. La chirurgia delle coronarie
Fra le malattie del sistema arterioso quelle delle coronarie stanno al primo posto come causa di mortalità, specialmente fra le popolazioni ad alto tenore di vita delle società occidentali.
Diversi metodi di analisi si sono affiancati all'elettrocardiogramma, che ancora recentemente era l'unico sostegno diagnostico, e permettono di affrontare il problema in modo veramente scientifico: primo fra tutti la coronaroventricolografia ha permesso di confermare la malattia e di precisarne localizzazioni e gravità, così da ottenere una visione precisa e quantificabile dell'albero coronarico; la prova elettrocardiografica dopo sforzo, la scintigrafia miocardica e lo studio del metabolismo miocardico hanno poi permesso di affinare ancor più la conoscenza dei diversi meccanismi dell'ischemia miocardica, di adattare a ciascuno la cura appropriata e soprattutto di precisare le indicazioni dell'intervento chirurgico di rivascolarizzazione del miocardio con innesto di vena per costituire un ponte aortocoronario, proposto e attuato da R. G. Favaloro (v., 1968).
Questo intervento, applicazione alle coronarie della tecnica usata fin dal 1949 da J. Kunlin nelle arteriopatie periferiche, consiste nell'uso della vena safena interna del malato prelevata nella lunghezza adatta per ottenere uno o più ponti; la presenza delle valvole obbliga a invertire il canale. In arresto circolatorio viene praticata, a valle della stenosi, un'anastomosi fra la o le coronarie da ripristinare e l'innesto venoso sezionato a 450; l'estremità prossimale dell'innesto viene suturata in anastomosi termino-laterale all'aorta ascendente (v. Kunlin, 1984).
Questo intervento è diventato molto rapidamente di moda e il numero di casi operati si è moltiplicato vertiginosamente, specie negli Stati Uniti. Oggi, dopo 15 anni dalla sua introduzione si può fare il punto sulle sue possibilità, giudicarne i risultati a distanza di tempo e precisarne le indicazioni in modo meno sommario, basandosi sui rischi operatori e sulla qualità dei miglioramenti ottenuti.
Esamineremo in successione le indicazioni degli esami coronarici speciali, i progressi tecnici dell'operazione, i risultati, immediati e a distanza di tempo, della chirurgia di rivascolarizzazione del miocardio, e infine le indicazioni operatorie, come le concepiamo oggi.
a) Esami speciali
Noi pensiamo che la coronarografia debba essere riservata ad alcuni casi specifici: angor fisso o invalidante, specie nei giovani; angor apparso in seguito a infarto in soggetti sotto i 40 anni; angor incostante, sia che si tratti di sindrome di rischio, sia di angor di Prinzmetal; angor delle valvulopatie aortiche che permetta di accertare l'esistenza di una coronaropatia che potrebbe indurre ad associare all'operazione alle valvole l'innesto di un ponte aortocoronario.
Le indicazioni esclusivamente diagnostiche della coronarografia secondo noi devono restare eccezionali. Con la ventricolografia associata si ottengono dati preziosi sulla dinamica ventricolare, che permettono di estendere i benefici della rivascolarizzazione a casi che sembrano, a priori, inoperabili (v. Bruschke e altri, 1978; v. Kennedy e altri, 1981).
L'elettrocardiogramma dopo sforzo rappresenta una prova indispensabile per la valutazione di un'insufficienza coronarica: evidentemente un infarto recente o una sindrome di rischio sono controindicazioni formali per questa prova.
La registrazione elettrocardiografica continua (monitoraggio) secondo il metodo di Holter permette di scoprire le turbe della ripolarizzazione e di giudicare gli effetti dei vari farmaci somministrati.
L'esplorazione del seno coronario e lo studio del metabolismo cardiaco sono metodi troppo particolari per poterli descrivere nel quadro di questo studio.
b) Progressi tecnici
Nel corso degli ultimi dieci anni sono intervenuti due grandi ordini di mutamenti nel campo della chirurgia delle coronarie.
I. Mentre all'inizio nel 70% degli operati veniva innestato un solo ponte, nel 20% due ponti e nel 10% tre ponti, in seguito si è diffusa la nozione di rivascolarizzazione completa, cioè dell'intervento consistente nell'apportare sangue ossigenato a valle di tutte le stenosi delle coronarie mediante tanti ponti quanti ne occorrono, intervento che oggi è ammesso e praticato dalla maggior parte delle équipes. Tuttavia il capitale venoso dell'operato non è illimitato e quindi sono state ideate nuove tecniche che permettono, mediante anastomosi in sequenza, di utilizzare, per esempio, un unico innesto per tre o quattro vasi coronarici. L'utilizzazione dell'arteria mammaria interna per costituire un ponte con l'arteria interventricolare anteriore offre una soluzione elegante e valida, che da un lato contribuisce a preservare una parte della disponibilità del capitale venoso e dall'altro permette di conservare a lungo termine la pervietà dell'innesto e la sua qualità funzionale, superiori a quelle dell'innesto venoso. Studi recenti hanno dimostrato anche la possibilità di utilizzare entrambe le arterie mammarie interne nei malati colpiti da lesioni plurivascolari (v. Favaloro, 1967 e 1968).
II. Nel 1977 A. Grüntzig propose e attuò una nuova tecnica applicabile nella cura di alcune stenosi coronariche: la dilatazione transluminale mediante introduzione di una sonda a palloncino gonfiabile nell'arteria femorale, guidata attraverso l'orifizio coronarico fino alla stenosi. Certe localizzazioni all'origine dell'interventricolare anteriore o del ramo destro costituiscono possibili indicazioni per questo metodo. Naturalmente occorre una stretta cooperazione fra radiologo e chirurgo, perché se il metodo fallisce non resta che il ricorso urgente alla sala operatoria per effettuare l'immediato innesto di un ponte. I risultati a distanza di questa nuova tecnica apparentemente molto promettente sono ancora troppo poco numerosi perché se ne possano trarre conclusioni in favore di un'estensione del metodo o di una sua limitazione a pochi casi ben scelti (v. Grüntzig, 1978; v. Guermonprez e altri, 1979). Il metodo di dilatazione transluminale trova una legittima indicazione in certe stenosi localizzate delle arterie degli arti: per quanto senza dubbio solo palliativa, questa tecnica è, in tale campo, di interesse indiscutibile, in quanto dotata di basso potenziale di rischio.
c) Risultati della chirurgia di rivascolarizzazione del miocardio
Le grandi serie di dati europee e americane possono far fede di una mortalità operatoria che è oggi dell'ordine del 2,5% per i malati operati a freddo.
Un'età superiore a 70 anni, la presenza di un'insufficienza cardiaca, l'associazione di un'ipertensione arteriosa, o una sindrome di rischio sono naturalmente altrettanti fattori di ulteriori rischi, fra cui il più grave e il più frequente è l'infarto postoperatorio. Il miglioramento delle tecniche operatorie, dei sistemi di protezione del miocardio, della sorveglianza e della rianimazione postoperatoria ha però permesso di ridurne l'incidenza, parallelamente a quella della mortalità immediata (v. Chesbro e altri, 1982; v. Conti e altri, 1977).
In quanto ai risultati a lungo termine, tutte le indagini statistiche giungono a risultati concordanti: la sopravvivenza si aggira fra l'85 e il 90% dopo 5 anni dall'intervento, fra il 65 e l'80% dopo 10 anni.
Non possiamo qui esaminare nei particolari questi risultati a lungo termine in base al tipo di angina pectoris, al numero di ponti messi in opera, allo stato del miocardio, al sesso e all'età dell'operato. È però importante conoscere la qualità della sopravvivenza degli operati alle coronarie: il 30% hanno ancora sintomi di angina da sforzo nei primi anni dopo l'operazione; dopo 10 anni questa cifra è vicina al 50%.
Vari studi hanno dimostrato alla coronarografia di controllo la stretta correlazione fra questi sintomi e la pervietà dell'innesto. Una parte degli innesti, variabile dal 10 al 20%, si occlude fin dal primo anno. L'errore tecnico e la malattia dell'innesto con iperplasia dell'intima si dividono in parti pressoché uguali la causa di questi fallimenti. Dopo 5 o 6 anni compare un fattore nuovo: lo sviluppo di aterosclerosi nel troncone venoso usato come arteria (v. Bourassa e altri, 1982; v. Sims, 1983; v. Takado e altri, 1976).
Dopo 10 anni circa il 50% degli innesti è occluso, mentre, paradossalmente, l'80% dei sopravvissuti dimostra ancora un miglioramento funzionale, anche se solo il 50% di essi non presenta sintomi.
È importante tornare a sottolineare che i ponti realizzati con l'arteria mammaria interna danno risultati a lungo termine migliori dei ponti venosi e sono raramente sede di aterosclerosi progressiva: secondo stime recenti, il 90% dei ponti fatti con l'arteria mammaria resta pervio e indenne da ateroma dopo 10 anni dall'innesto.
Qual è dunque in queste condizioni il reinserimento socioeconomico degli operati? La ripresa del lavoro dipende da un considerevole numero di condizioni che, come è facile immaginare, variano da paese a paese, tanto che le cifre fornite si collocano a ventaglio fra il 17 e il 92%. Ci si può anche chiedere se in caso di ripresa dei dolori sia raccomandabile la ripetizione dell'operazione. La recidiva del dolore è sempre un segno di allarme che deve portare a una coronarografia di controllo e a un nuovo intervento. Questo comporta rischi maggiori di quello eseguito la prima volta: estensione dell'ateroma sulle arterie coronarie, aderenze che rendono difficile l'isolamento delle coronarie dalla superficie cardiaca, disponibilità ridotta di vene spiegano il 4% di mortalità (v. Cosgrove e altri, 1982; v. Deloche e altri, Traitement..., 1975; v. Hammermeister e altri, Variable... ed Evidence..., 1979; v. Harris e altri, 1980; v. Hurst e altri, 1978; v. Jones e altri, 1978; v. Kannel e Feinleib, 1972; v. Norris e altri, 1981; v. Nunley e altri, 1983; v. Read e altri, 1978).
d) Indicazioni operatorie
La malattia coronarica è proteiforme e oltre che attraverso l'angina pectoris costante, che ne è la manifestazione più frequente, si manifesta spesso attraverso l'angina instabile, che segnala il periodo premonitore dell'infarto o rappresenta una sindrome di rischio, l'angor di Prinzmetal e infine l'infarto del miocardio (v. trombosi coronarica). L'ateroma è la causa più comune della malattia coronarica, ma esistono anche altre eziologie, sebbene più rare: sifilide, malattie congenite, spasmo. Alla classica Trinitrina, che ha ancora un posto importante nella cura dell'angina pectoris stabile, è venuto ad aggiungersi, in questi ultimi vent'anni, tutto un ventaglio di farmaci particolarmente attivi: i betabloccanti e i calcioinibitori in prima fila. In presenza di una sindrome di rischio il trattamento medico iniziale sarà più aggressivo e comprenderà l'associazione con antagonisti del calcio. Rimane tuttavia un numero notevole di malati, per cui il trattamento medico è poco efficace o vano, che restano candidati alla chirurgia; l'intervento chirurgico è indicato anche per chi è colpito dalla stenosi del tronco comune della coronaria sinistra, o da stenosi bitronculare o ancora da un angor invalidante o, a più forte ragione, da una sindrome di rischio che non si riesce a ‛raffreddare' (v. Berg e altri, 1981; v. Dubost e Blondeau, 1962; v. Dubost e altri, Surgery..., 1971; v. Rentrop e altri, 1981; v. de Riberolles e altri, 1975; v. Roberts, 1983).
Tutto sommato oggi disponiamo di una nuova arma nel trattamento delle conseguenze dell'ateroma coronarico. Abbiamo dimostrato che non si tratta di una ‛cura' radicale della malattia, ma solo di un procedimento palliativo che sopprime il dolore in un numero rilevante di casi, ma che non può pretendere di deviare il corso dell'ateroma coronarico: l'innesto di un ponte ottiene però risultati superiori alle cure mediche, salvo per i casi in cui, è colpito un solo vaso. Anzi, recenti studi americani dimostrano che anche la durata della vita è aumentata di una percentuale significativa (v. Bulkley e Hutchins, 1977; v. Burggraf e Parker, 1975; v. Thurer e altri, 1979; v. Varnauskas e altri, 1980; v. Vlietstra e altri, 1977).
Comunque in Francia si è lontani dal numero di interventi degli Stati Uniti, senza dubbio esagerato agli inizi, mentre oggi si tende a evitare l'indicazione chirurgica per i soggetti asintomatici, per quelli colpiti a un solo vaso o per coloro in cui le cure mediche danno risultati favorevoli. I nostri cardiologi si sono attenuti quasi unanimemente a questi criteri fin dagli inizi.
Vi sarebbe inoltre, in Francia, un numero minore di soggetti affetti da aterosclerosi: un recente studio epidemiologico evidenzia che, nonostante un'ingestione di lipidi e di idrati di carbonio comparabile con quella di altri paesi occidentali sviluppati, la mortalità francese per cause arteriose si colloca fra quella del Giappone e quella della Grecia, di gran lunga dietro la Gran Bretagna e ancora più dietro gli Stati Uniti e a gran distanza dalla Finlandia. L'abbondante consumo di vino avrebbe sulla funzione epatica un'azione deleteria capace di indurre un certo grado di ipocoagulabilità, che proteggerebbe così una percentuale notevole della popolazione maschile (v. Richard, 1983).
6. Altre indicazioni della chirurgia cardiaca
Accanto ai ponti aortocoronarici la chirurgia cardiaca ha la possibilità di estendersi a certe complicazioni dell'infarto del miocardio e al trattamento di alcune alterazioni del ritmo cardiaco.
a) La rottura recente del setto interventricolare
La rottura del setto interventricolare è una temibile complicazione dell'infarto che fino a questi ultimi anni era considerata fuori dalla portata della chirurgia. Le piccole comunicazioni interventricolari postinfarto erano già dominio della chirurgia cardiaca convenzionale, ma le grandi rotture sembravano inoperabili e conducevano alla morte in tempi rapidi. Oggi le possibilità offerte dalla circolazione assistita, in particolare dal palloncino pulsante intra-aortico, consentono una sopravvivenza dell'ordine del 50% dei ricoverati in rianimazione che nel corso di un infarto profondo abbiano sviluppato un rilevante cortocircuito arterovenoso, causa di edema polmonare e di oligoanuria e indicazione di uno shock spontaneamente irreversibile. La contropulsione può non essere efficace: in questo caso la partita è perduta. Ma se invece riesce a ristabilire qualche parametro favorevole, allora si può tentare un intervento che può avere risultato favorevole e mantenerlo con l'aiuto del palloncino intra-aortico nel periodo postoperatorio (v. cap. 10, § a; v. Dubost e altri, La fermeture..., 1968; v. Piwnica e altri, 1976; v. Soots e altri, 1982).
Un'assistenza cardiaca temporanea può anche essere ottenuta eseguendo un by-pass fra orecchietta sinistra e arteria femorale che, mediante una pompa interposta, allevierà il compito del ventricolo sinistro per tutto il tempo necessario (v. cap. 10, § c).
b) Gli aneurismi del ventricolo
Gli aneurismi rappresentano una complicazione chirurgica dell'infarto del miocardio (trombosi coronarica).
La dilatazione localizzata della parete del ventricolo che ne deriva spiega i principali sintomi che li caratterizzano: alterazioni del ritmo, emboli arteriosi e insufficienza cardiaca.
Ciascuna di queste complicazioni può assumere il ruolo più rilevante. La ventricolografia permette di precisare la localizzazione della dilatazione, i suoi rapporti con il ventricolo e soprattutto la dimensione del colletto che da esso la separa. In caso di lesioni delle coronarie, è indispensabile una coronarografia in vista dell'innesto di uno o più ponti. L'operazione, condotta in circolazione extracorporea, consiste nell'ablazione dell'aneurisma, realizzata in modo che il taglio arrivi al limite del miocardio sano. Verrà conclusa con un'accurata sutura del taglio e con l'eventuale innesto del o dei ponti coronarici necessari. Il rischio operatorio è dell'ordine del 15%, i risultati a distanza sono buoni.
c) Il trattamento chirurgico di alcune alterazioni del ritmo.
Nuove possibilità chirurgiche si sono aperte anche nel campo delle aritmie ventricolari maligne in conseguenza di una migliore conoscenza della localizzazione delle reti di conduzione, la cui eccitazione determina lo sviluppo delle aritmie. Gli studi di G. Guiraudon rivestono un'importanza fondamentale: basandosi sull'ipotesi che il tessuto irritabile sia localizzato in prossimità della superficie endocardica, Guiraudon propose e realizzò un intervento che consiste nel praticare un incisione circolare della superficie dell'endocardio del ventricolo sinistro. Con questa semplice tecnica sono stati ottenuti risultati interessanti (v. Guiraudon e altri, 1978).
7. La chirurgia degli aneurismi dell'aorta toracica.
Gli aneurismi dell'aorta toracica e toracoaddominale sono inclusi nella chirurgia cardiaca in quanto alcune delle loro localizzazioni richiedono metodi di intervento analoghi.
Sostanziali perfezionamenti tecnici permettono di affrontare con maggiore facilità tutte le localizzazioni e tutti i tipi di ectasia che colpiscono l'aorta toracica (v. Dubost e altri, À propos..., 1951, Resection..., 1952 e 1970; v. Dubost e Carpentier, 1984; v. Dubost e Nottin, 1979).
L'apertura dell'aneurisma seguita da innesto in situ è diventata, per la sua semplicità, la tecnica di elezione in un gran numero di casi: offre, infatti, il notevole vantaggio di ridurre la durata dell'intervento e i rischi di emorragia.
L'impiego di protesi in dacron perfettamente impermeabilizzate al sangue reso incoagulabile con eparina, i perfezionamenti dei metodi di circolazione extracorporea e delle tecniche di protezione del miocardio, la possibilità di ricorrere in alcune circostanze a una pompa di autotrasfusione hanno consentito progressi decisivi che permettono di trattare questi aneurismi con il minimo rischio operatorio.
a) Gli aneurismi dell'aorta ascendente.
Se gli aneurismi sacciformi, per lo più di origine sifilitica, sembrano vicini a scomparire, si osservano per converso con frequenza crescente gli aneurismi fusiformi.
Gli aneurismi sacciformi rappresentano solo l'8% degli aneurismi dell'aorta ascendente sottoposti a intervento. Hanno la particolarità di poter essere escissi, in certi casi, per semplice pinzatura laterale dell'aorta ascendente, metodo sufficiente se la base di attacco dell'aneurisma sull'aorta non supera i due centimetri. Dimensioni maggiori obbligano al clampaggio completo dell'aorta in circolazione extracorporea. In questo caso la riparazione dell'aorta si effettua mediante un lembo di dacron o una protesi tubolare (v. Dubost e Heim de Balsac, 1951).
La chirurgia degli aneurismi fusiformi dell'aorta ascendente è andata evolvendosi, da vent'anni a questa parte, verso tecniche di exeresi sempre più radicali. Dopo la resezione parziale dell'aneurisma, seguita da sutura diretta, e la sostituzione con protesi sopracoronarica dell'aorta ascendente, oggi il favore di alcune équipes chirurgiche si orienta verso la sostituzione totale dell'aorta ascendente, con reimpianto degli orifizi coronarici. La maggior parte degli aneurismi fusiformi sono accompagnati da una lesione della valvola aortica che costituisce di per sé un'indicazione all'intervento chirurgico. Per questo insistiamo sui due fatti seguenti: a) la sola correzione di una valvulopatia aortica, che lasci in situ un rigonfiamento aneurismatico anche moderato, si dimostra sempre nefasta nel decorso postoperatorio immediato o remoto; b) la cura isolata di un aneurisma espone al rischio di scompenso cardiaco acuto o progressivo, provocato da una lesione valvolare sottostimata o non identificata.
Pertanto l'intervento comporta pressoché sempre due tempi operatori e cioè la messa in opera di una valvola artificiale e la cura dell'aneurisma.
Gli aneurismi di origine distrofica sono di gran lunga i più frequenti (90%). Si tratta in tre quarti dei casi di aneurismi veri e in un quarto di aneurismi dissecanti dell'aorta ascendente. L'insufficienza aortica richiede sempre la sostituzione della valvola, sia che si tratti di una anuloectasia, sia che si tratti di un distacco della valvola per dissecazione retrograda. La cura dell'aneurisma può essere realizzata secondo tre procedimenti differenti: la scelta verrà effettuata dopo l'inventario delle lesioni.
1. Nella maggioranza dei casi in cui l'ectasia non comporta che un'ascesa limitata degli orifizi coronarici, scegliamo la sostituzione con una protesi sopracoronarica dell'aorta. Questa tecnica ormai collaudata si è dimostrata soddisfacente anche a lungo termine, nella nostra esperienza, e non ha dato luogo ad alcuna recidiva dell'aneurisma.
2. In presenza di un voluminoso aneurisma con notevole spostamento verso l'alto degli orifizi coronarici, come nella sindrome di Marfan, diventa lecito praticare la sostituzione completa dell'aorta ascendente con reimpianto delle coronarie, per non lasciare in situ un moncone aortico fortemente dilatato.
3. È frequente constatare che solo l'orifizio coronarico destro, situato sulla grande curva dell'ectasia, è molto spostato verso l'alto. In questo caso preferiamo l'impianto di una protesi tubolare indietro sopra l'orifizio coronarico sinistro e in avanti sopra l'anello aortico: soltanto l'ostio coronarico destro, facilmente accessibile, viene reimpiantato sulla protesi, direttamente o con un innesto di vena safena. In tutti i casi usiamo pezze di dacron scaldate in autoclave a 132 °C per tre minuti dopo essere state impregnate di sangue eparinizzato, in modo che diventino assolutamente impermeabili al sangue reso incoagulabile. La protezione del miocardio durante il clampaggio dell'aorta è assicurata con cardioplegia. Questi perfezionamenti hanno permesso di abbassare il rischio dell'intervento al 10%.
b) Gli aneurismi dell'arco aortico.
La chirurgia dell'arco aortico, inaugurata da D. Cooley nel 1955, incontra ancora oggi difficoltà tecniche, fra le quali la più preoccupante è la preservazione del territorio encefalico durante l'esclusione vascolare.
La circolazione extracorporea con ipotermia profonda e arresto circolatorio, che avevamo praticato nel 1959 e poi abbandonato, ritrova il favore di alcune équipes in quanto l'arresto circolatorio facilita l'apertura dell'aneurisma, l'impianto della protesi all'interno della sacca e il reinserimento dei tronchi sopraortici. L'intervento non dura a lungo, ma l'ipotermia profonda impone certe riserve per i rischi encefalici in soggetti ateromatosi.
Ci è parso possibile trattare più semplicemente questi aneurismi senza far ricorso alla circolazione extracorporea: su una protesi tubolare impiantata fra aorta ascendente e aorta addominale vengono reimpiantati i tronchi sopraortici con inserimento di protesi e l'aneurisma viene escluso ai due capi (v. figg. 43 e 44; v. Cooley e altri, 1966).
c) Gli aneurismi dell'aorta toracica discendente.
Fra gli aneurismi dell'aorta toracica, questi rappresentano la localizzazione più favorevole sul piano chirurgico. La complicazione maggiore di questo intervento è la paraplegia ischemica, che si può manifestare quando il clampaggio dell'aorta toracica discendente in normotermia si protrae per oltre trenta minuti. In funzione delle lesioni constatate verrà deciso quale procedimento di esclusione dell'aorta adottare. Noi propendiamo per l'intervento con semplice clampaggio dell'aorta a monte e a valle dell'aneurisma, a condizione che l'apertura e l'inserimento della protesi possano essere effettuati in trenta minuti.
Nel caso di un aneurisma voluminoso abbiamo fatto ricorso alla circolazione extracorporea parziale femoro-femorale (v. DeBakey e Cooley, 1953).
d) Gli aneurismi dell'aorta toracoaddominale.
Il restauro completo dell'aorta toracoaddominale deve limitare al minimo la durata dell'ischemia viscerale e rispettare l'integrità dell'arteria di Adamkiewicz a terminazione spinale. Attualmente è accertato, alla luce dell'impressionante serie di dati di S. Crawford, che si possono ottenere risultati eccellenti senza protezione dei visceri. Crawford è sostenitore della tecnica più semplice e più rapida, che è l'apertura con impianto di una protesi intra-aneurismatica. Dopo il clampaggio dell'aorta sopra e sotto l'aneurisma, questo viene inciso verticalmente e le diramazioni collaterali vengono controllate dall'interno dell'aneurisma mediante sonde a palloncino gonfiabile. La protesi viene impiantata all'interno dell'aneurisma sull'aorta prossimale e poi le diramazioni viscerali vengono reinserite dall'alto in basso, direttamente sulla protesi, e subito riperfuse. Dopo l'impianto distale della protesi sull'aorta, la sacca aneurismatica viene richiusa sopra la protesi.
Nei dati forniti da Crawford l'apertura, con impianto di una protesi, degli aneurismi toracoaddominali estesi a tutta l'aorta toracica discendente espone a un rischio di paraplegia nel 20% dei casi. Il reinserimento sulla protesi di una pastiglia di aorta comprendente le coppie di arterie intercostali e/o lombari a terminazione spinale permette di ridurne la frequenza. In certe localizzazioni si può adottare la tecnica della rivascolarizzazione retrograda (v. Dubost e Carpentier, 1984; v. Crawford e Schuessier, 1980).
Noi pensiamo che gli aneurismi toracoaddominali estesi a tutta l'aorta discendente possano essere trattati più semplicemente per esclusione. L'intervento consiste nell'impianto di una protesi tubolare fra aorta ascendente e aorta addominale sottorenale, escludendo poi l'aneurisma. Il merito di aver realizzato per la prima volta questo tipo di intervento spetta a Shumacker. L'esclusione bipolare dell'aneurisma obbliga a reinserire sulla protesi le diramazioni viscerali digestive e renali. La trombosi progressiva della sacca aneurismatica lascia il tempo di sostituire alla circolazione nelle arterie intercostali a terminazione spinale una circolazione collaterale.
L'esclusione dell'aneurisma solo all'estremo superiore ha lo scopo di sgonfiare la sacca aneurismatica ed evitarne l'evoluzione verso la rottura, e dispensa dal reimpianto delle diramazioni viscerali.
Questo intervento è eseguito mediante sternotomia mediana verticale prolungata in laparotomia mediana xifopubica. L'esclusione dell'aneurisma viene ottenuta o con taglio e sutura, oppure, più semplicemente, con una pinza speciale di Carpentier lasciata in situ.
8. Trapianti cardiaci.
Vivere con il rene di un altro era diventata verso la metà degli anni sessanta una realtà terapeutica che offriva già ragionevoli percentuali di successo, di anno in anno crescenti in virtù delle possibilità di accoppiamento donatore-ricevente, dell'uso di farmaci antirigetto efficaci e anche della possibilità di servirsi di un rene consanguineo. I lavori sul trapianto di rene iniziati con P. Milliez nel 1950 erano stati da noi abbandonati dopo tre allotrapianti ortotopici di reni di cadavere, condotti senza successo durevole agli inizi del 1951. Allora, infatti, non si sapeva proteggere il rene del donatore dall'ischemia temporanea e neppure controllare il rigetto, nonostante che fin da questi primi tentativi fossero somministrate al malato massicce dosi di cortisone; la sopravvivenza più lunga fu solo di 17 giorni (v. Dubost e altri, Resultats..., 1951).
Anche altri tentativi condotti da R. Ktiss a Parigi e da Hume e Merrill negli Stati Uniti, nello stesso anno, si erano conclusi con il fallimento. Nel 1954 Merrill dimostrò l'origine genetica del rigetto con la riuscita di una serie di trapianti fra gemelli monozigotici; si sapeva già da una ventina di anni che i trapianti di pelle fra gemelli veri non erano soggetti a rigetto e l'applicazione di questa nozione al trapianto di un organo vitale fu un'audace estensione dello stesso principio (v. Hume e altri, 1955; cfr. Küss, in Dubost, 1984).
Lo scopo era arrivare al trapianto di rene anche fra non parenti. Fu però necessario attendere fino agli inizi degli anni sessanta per ottenere l'immunosoppressione nel ricevente, inizialmente per irradiazione totale poi, ben presto, con mezzi farmacologici più maneggevoli. Da quel momento il trapianto di rene entrò nel campo delle applicazioni cliniche e apri la via ai lavori sperimentali miranti al trapianto del fegato e del cuore.
Nel 1963 Th. E. Starzl realizzò il primo trapianto ortotopico di fegato, operazione di grande difficoltà tecnica, oggi eseguita abitualmente (v. Starzl e altri, 1963).
Pressappoco nella stessa epoca iniziammo, con J. P. Cachera, nel Laboratorio di Broussais, i primi trapianti sperimentali di cuore che dopo qualche anno di sforzi, seguendo l'esempio di N. Shumway, realizzammo regolarmente con una percentuale di successi via via crescente.
Il primo trapianto sull'uomo, eseguito nel 1967 da Ch. Barnard, suscitò un immenso entusiasmo e numerose équipes nel mondo si affrettarono a seguirne l'esempio, ma accumularono gli insuccessi dovuti alla fretta. Con Cachera attendemmo di disporre di una sala sterile prima di eseguire a nostra volta, nel maggio del 1968, un trapianto su un padre domenicano volontario, per quella che lui sapeva essere un'operazione a carattere sperimentale. Qualche settimana dopo eseguimmo un secondo trapianto e infine un terzo. La morte perioperatoria dell'ultimo paziente, il decesso del secondo dopo un anno di continua degenza in ospedale, e dopo diciotto mesi la scomparsa del primo operato ci indussero a interrogarci sulla legittimità di questo genere di interventi. I cardiologi si mostravano reticenti a causa dei nostri insuccessi e anche di quelli riportati dalla letteratura, mentre il problema del donatore diventava pressoché insolubile nell'ambito di un ospedale privo del reparto di neurochirurgia. Presi da altri problemi decidemmo di interrompere il nostro programma di trapianti, pronti a riprenderlo se qualche scoperta fondamentale o qualche nuovo farmaco avessero trasformato il trapianto in un atto terapeutico (v. Barnard, 1967; v. Copeland e Stinson, 1979; cfr. Dausset, in Dubost, 1984; v. Dubost e Cachera, 1968, Trois cas..., Problèmes... e A human..., 1969 e 1970; v. Dubost, 1969, 1970 e 1974; v. Jamieson e altri, 1979 e 1981).
In questo modo l'esperienza accumulata durante quasi vent'anni nel campo del trapianto del rene e poi del fegato contribuì alla nascita e allo sviluppo del trapianto del cuore: questi interventi infatti, in apparenza assai diversi, quando i problemi tecnici siano stati risolti sono accomunati da un insieme di problemi correlati.
Certo, l'insuccesso di un trapianto di rene non ha lo stesso significato dell'insuccesso di un trapianto di fegato o di cuore; ci si può proporre un secondo trapianto, seguito in certi casi perfino da un terzo con il rene di un consanguineo. Inoltre, il rene artificiale rappresenta un ausilio importante, sia durante l'attesa del donatore adatto, sia per permettere il controllo di complicazioni postoperatorie.
Il trapianto di un organo non doppio appare subito più aleatorio, anche se si è avuta notizia di iterazioni del trapianto di cuore. In assenza di un fegato e di un cuore artificiali, il deperimento di coloro che sono in attesa del donatore sarà sempre molto maggiore. Una protesi non funzionale sarà sinonimo di morte sempre, se si tratta del fegato, quasi sempre nel caso del cuore, salvo per i seguaci dei trapianti eterotopici.
Sono questi i gravi motivi che rendono necessaria una migliore conoscenza dei meccanismi del rigetto, sia che si tratti di controllarli sia, meglio, di prevenirli. A questo riguardo J. Dausset ha fornito una delle chiavi più attese per il successo, la conoscenza del sistema HLA, che doveva permettere, prima nel trapianto di rene e poi in quello di cuore (ritenuto meno antigenico), di raggiungere una percentuale di successo migliore, perché fondata su basi scientifiche (v. chirurgia dei trapianti, in chirurgia).
Esamineremo ora l'evoluzione del modo di affrontare il trapianto cardiaco in quelle équipes che, nel mondo, dopo qualche anno di disinteresse, hanno ripreso in considerazione il problema, orientandosi lungo due direttrici distinte: l'una, sostenuta da Shumway, prosegue sulla via dei trapianti ortotopici; l'altra, raccomandata da Barnard, consiste nell'innesto di un cuore in parallelo, accanto al cuore del ricevente lasciato al suo posto (trapianto eterotopico).
Discuterò in seguito le possibilità teoriche del cuore artificiale meccanico, sia come sostituto, sia come aiuto temporaneo in attesa del trapianto.
Accanto a questi aspetti esclusivamente tecnici, che contemplano da qualche tempo anche la possibilità del trapianto in blocco di cuore e polmoni, converrà discutere anche alcune questioni di ordine etico, che si pongono sempre molto acutamente quando si tratta delle indicazioni del trapianto, delle modalità di scelta del ricevente, dei fondamenti del consenso, dei costi dell'operazione, delle condizioni in cui la sopravvivenza assicurata da un altro cuore diventa accettabile.
a) Il trapianto ortotopico.
Quella del trapianto ortotopico è oggi la tecnica più largamente adottata.
Dal 1968 al 1981 Shumway ha effettuato 227 trapianti su 206 pazienti, con una mortalità perioperatoria del 26% (54 operati). Le principali cause di fallimento a termine sono rappresentate da: infezioni, causa di 77 morti (58%), di cui 56 avvenute nel corso del primo anno; rigetto, che occupa il secondo posto con 24 morti (18,3%), 23 delle quali sopravvenute durante i primi due anni; ateroma coronarico, il cui sviluppo nelle arterie dell'organo trapiantato è per Shumway la terza causa di morte negli anni successivi al secondo dopo il trapianto (14 decessi, cioè il 10,7%); complicazioni maligne (8, dopo il quinto anno).
Le statistiche più recenti di Shumway mostrano un costante miglioramento della percentuale degli operati sopravvissuti per più di un anno, causato soprattutto dai metodi con cui sono applicate oggi le cure durante i primi tre mesi; la partita, però non è mai vinta e il numero dei sopravvissuti diminuisce regolarmente con il passare degli anni.
Ciononostante da qualche tempo le équipes di trapianto cardiaco, un po' dovunque nel mondo, sembrano uscite dal pessimismo che ne frenava le ambizioni e hanno ripreso i lavori, incoraggiate dai recenti risultati riferiti da Shumway e dai suoi collaboratori ed esaltati da coloro che non esitano ad affermare che il trapianto di cuore è oggi altrettanto praticabile quanto il trapianto di rene.
Sembra che almeno quattro fattori abbiano contribuito a questa ripresa, ma fra questi non vi è quello che dovrebbe occupare il primo posto: la compatibilità nel sistema HLA. Paradossalmente i trapianti non hanno ripreso nuovo slancio per le ricerche di Dausset, poiché i tentativi di accoppiamento si dimostrano praticamente irrealizzabili nel campo del cuore. Come sottolinea R. Y. Calne, è un'ironia notare che l'enorme proliferazione delle ricerche nel campo dell'immunologia fondamentale non ha, allo stato attuale, modificato sensibilmente i risultati terapeutici. I quattro fattori di ripresa sono:
1) la selezione rigorosa di coloro che vengono sottoposti al trapianto, che devono avere meno di 50 anni, appartenere alla IV classe secondo la classificazione della New York Hearth Association, avere prospettive di sopravvivenza inferiori a sei mesi, non presentare infezioni nè alcuna traccia recente di embolo polmonare. Fegato e reni devono risultare indenni così come il sistema arterioso periferico e cerebrale. I candidati al trapianto devono inoltre avere una psicologia di livello elevato e, naturalmente, dare il proprio consenso agli orientamenti clinici che saranno loro illustrati;
2) la semplificazione dei criteri concernenti il donatore. Si deve trattare di un individuo giovane in stato di morte cerebrale, indenne da lesioni maligne o infettive e con volume cardiaco adatto alla gabbia toracica del ricevente. La compatibilità nel sistema HLA, non è più considerata decisiva, si impone solo l'identità nel sistema ABO;
3) la scoperta precoce del rigetto nell'operato. La pratica della biopsia endomiocardica ripetuta, per quanto rappresenti una grave costrizione per il malato, ha permesso a Shumway di rilevare i segni precoci del rigetto e di intervenire con rimedi efficaci molto prima della comparsa dei segni chimici o elettrici;
4) l'uso dei nuovi farmaci antirigetto.
In questo campo la scoperta della Ciclosporina A rappresenta un coadiuvante essenziale: non che abbia soppiantato tutti gli altri farmaci precedentemente usati, ma la sua azione specifica sui linfociti T all'origine del rigetto, pur rispettando le cellule che assicurano la lotta contro l'infezione, ha permesso di diminuire il dosaggio dei cortisonici che, in forti dosi, sono responsabili di complicazioni infettive. Scoperta da J. Borel, ricercatore dei Laboratori Sandoz, la sua azione come agente immunosoppressore fu dimostrata nel 1972. Stinson e collaboratori, nel corso di esperimenti condotti presso il Laboratorio di Stanford con Ciclosporina A su primati su cui erano stati effettuati trapianti di cuore solo o di cuore-polmoni, osservarono un prolungamento della sopravvivenza, per quanto il prodotto non controllasse regolarmente il rigetto. Inoltre, somministrata agli uomini da Shumway, la Ciclosporina A ha fatto diminuire il numero delle infezioni mortali e quello degli episodi di rigetto nelle prime fasi postoperatorie (v. Borel e altri, 1977; v. Caine e altri, 1977; cfr. Stinson, in Dubost, 1984). Non sembra possibile invece per ora pronunciarsi sull'efficacia di questo medicinale per il controllo delle complicazioni tardive. Tuttavia, la qualità della sopravvivenza conta tanto quanto la sopravvivenza stessa, quando si tratta di decidere un trapianto che per molto tempo, almeno un decennio, è sembrato un atto di ostinazione terapeutica destinato a concludersi, ancora recentemente, con una mortalità spaventosa a breve e medio termine, e che per di più legava i sopravvissuti a costrizioni terapeutiche particolarmente pesanti, senza parlare degli effetti collaterali dei farmaci somministrati, in particolare dei cortisonici.
Solo il tempo risponderà agli interrogativi che oggi ci poniamo sull'uso della Ciclosporina A, senza alcun dubbio dotata di un certo potenziale di tossicità i cui effetti nocivi non sono ancora perfettamente definiti.
b) Il trapianto eterotopico.
Questo tipo di trapianto sembra oggi aver conservato scarso favore. Barnard, che ne fu il promotore, nel 1981 aveva operato trenta pazienti, ottenendo una sopravvivenza da quattro mesi a cinque anni e mezzo dopo il trapianto nel 5o% dei casi. Il numero dei sopravvissuti oltre un anno raggiungeva il 61%; dei nove ultimi operati otto sono sopravvissuti oltre un anno e la morte del nono è stata causata da un secondo trapianto. È interessante notare che uno degli otto operati ha subito l'ablazione del cuore trapiantato per una forma di rigetto incontrollabile, ed era in attesa di un secondo cuore.
Barnard sottolinea il ruolo che può assumere il cuore del ricevente nel corso di episodi di rigetto, purché non abbia raggiunto l'ultimo stadio di degrado, venendo in aiuto del cuore trapiantato. Ben poche équipes lo hanno seguito; i casi operati in questa maniera fuori da Città del Capo si contano sulle dita di una mano. Forse questa tecnica può assolvere un compito ed essere applicata in pochi casi specifici: soggetti più anziani, diagnosi incerte e anche trapianti sui più giovani.
c) L'allotrapianto cuore-polmoni.
Per quanto il trapianto cardiaco, ortotopico o eterotopico, corrisponda alla maggioranza delle esigenze, c'è però una categoria di malati, colpiti contemporaneamente al cuore e ai polmoni, per i quali sarebbe necessaria la sostituzione dell'intero blocco. Benché fino a oggi tutti i tentativi di trapianto dei soli polmoni si siano conclusi con un insuccesso, Shumway ha giudicato la grande esperienza acquisita nel campo dei trapianti cardiaci capace di permettergli di migliorare i risultati ottenuti nel trapianto polmonare associato al trapianto cardiaco. I risultati sperimentali sono sembrati all'équipe di Stanford abbastanza incoraggianti da autorizzare il tentativo di eseguire nell'uomo l'allotrapianto cuore-polmoni, utilizzando una tecnica operatoria semplificata, derivata dalle osservazioni compiute sui Primati, che sono in grado di tollerare una denervazione polmonare completa. La decisione è derivata anche dalla speranza di ottenere una sopravvivenza a lungo termine grazie all'impiego della Ciclosporina A. Nel 1981 Shumway effettuò due trapianti cuore-polmoni, uno su un paziente colpito da una gravissima ipertensione polmonare dipendente da una cardiopatia primaria, l'altro su un malato affetto da un'insufficienza ventricolare destra in conseguenza di una malattia vascolare polmonare primaria, refrattaria a ogni cura. Dopo i primi due sono stati effettuati altri cinque trapianti di questo tipo: quattro dei sette operati sono sopravvissuti all'intervento. Questo tipo di operazione avrà sempre, è evidente, indicazioni limitate: reso difficile dagli aspetti tecnici, che ne fanno uno degli interventi più ardui dell'intero bagaglio chirurgico, è anche ostacolato dalla difficoltà di trovare un donatore valido, i cui polmoni non abbiano sofferto lesioni durante il periodo di respirazione artificiale, più o meno protratto, precedente il prelievo. Resterà però l'unico rimedio possibile nei casi suddetti, perché il cuore artificiale meccanico non può in alcun modo sopperire alla deficienza dei polmoni (v. Shumway e altri, 1981).
d) Indicazioni dei trapianti cardiaci.
Oggi, dunque, il trapianto cardiaco ha conquistato un posto nel bagaglio cardiochirurgico. Certo le indicazioni sono diminuite con i progressi ottenuti, in particolare nel campo della chirurgia delle coronarie; rimangono le miocardiopatie primarie, che rappresentano oggi l'indicazione più frequente. La sopravvivenza è assicurata a prezzo di severe costrizioni limitative, come la somministrazione di farmaci con effetti collaterali pericolosi (secondo informazioni recenti, la Ciclosporina A rappresenta, per la sua azione dannosa sul rene, un fattore ipertensivo) e la continua ripetizione di biopsie miocardiche per identificare precocemente il rigetto. Nella sua forma attuale il trapianto cardiaco, superato lo stadio sperimentale, sembra aver raggiunto ormai lo stadio terapeutico, ma con una limitazione notevole: la mancanza di donatori. Personalmente nel 1969 abbiamo abbandonato la pratica dei trapianti cardiaci, dopo aver effettuato il primo in Europa con una sopravvivenza di 18 mesi, perché il nostro ospedale non dispone di un reparto di neurochirurgia che è quello da cui proviene la maggior parte dei donatori.
Con l'aumento della richiesta oggi il problema si ripropone, forse in termini un po' meno drammatici, grazie alla possibilità di conservare per qualche ora, per mezzo del freddo, il cuore prelevato. Studi recenti hanno dimostrato che la perfusione continua del cuore del donatore con una soluzione di Krebs ossigenata a basso ematocrito migliora in modo significativo il funzionamento del cuore trapiantato, rispetto a quello del cuore conservato per semplice ipotermia. Comunque il cuore artificiale meccanico resta una necessità, sia nell'impiego temporaneo in attesa di un donatore, sia per il trapianto definitivo in quegli ammalati che non presentano i requisiti occorrenti per il trapianto normale.
Un'ultima speranza: il trapianto di un cuore animale. È stato il primo tentativo di trapianto, effettuato da J. Hardy. Seri studi sperimentali, ma prima dell'avvento della Ciclosporina A, sono stati condotti da L. Bailey a Loma Linda, ma senza duraturi successi. La prevedibile comparsa di nuovi agenti immunosoppressori potrebbe anche portare un inizio di soluzione di questo appassionante problema (v. Hardy, 1970). Recentemente la stampa ha diffuso la notizia che Bailey ha effettuato il trapianto del cuore di un babbuino su un neonato condannato; la sopravvivenza è stata di tre settimane. Anche la stampa non specializzata è stata subito invasa da opposte prese di posizione su questo tentativo: per alcuni si tratta di un tentativo eticamente indifendibile, per altri di un tentativo terapeutico accettabile se si considera il cuore una semplice pompa automatica. Il problema genetico, però, è ancora lontano dall'essere risolto.
9. Il cuore artificiale meccanico.
Le difficoltà incontrate nell'attuazione dei trapianti cardiaci hanno indotto varie équipes a dedicarsi alla realizzazione sperimentale di un cuore artificiale meccanico innestabile: non soggetto a rigetto, sarebbe la risposta ideale ai problemi della sostituzione cardiaca.
Tutti i tipi di cuore artificiale innestabile comprendono tre parti: una pompa cardiaca innestata nel torace al posto del cuore; una fonte di energia destinata ad alimentare la pompa; un sistema di regolazione che permetta di adattare la pompa alle necessità dell'organismo (v. Carpentier, 1980 e The artificial..., 1981; v. Carpentier e Piekarski, 1983; v. Lapeyre e Carpentier, 1979).
I problemi nascono dalla difficoltà di reperire materiali emocompatibili e dotati di resistenza meccanica di lunga durata, dalla difficoltà di miniaturizzare una sorgente di energia di grande affidabilità e infine dalla difficoltà di effettuare la regolazione automatica della pompa cardiaca.
a) La pompa cardiaca.
Si stanno sperimentando due tipi di pompe cardiache: le pompe a membrana e quelle centrifughe. Nel primo caso la pompa copia, più o meno alla lontana, la morfologia del cuore umano, con due ventricoli e due vasi di uscita. Sul piano meccanico è possibile fabbricare un insieme come questo, alloggiato in un involucro inestensibile, i cui ventricoli si comprimono ritmicamente assicurando una portata destra e una sinistra nei limiti fisiologici.
Molto più difficile è, invece, ottenere un rivestimento delle cavità con un materiale a debole potenziale tromboembolico.
Carpentier e collaboratori usano biopolimeri come elementi di rivestimento sia della superficie interna delle cavità del cuore artificiale, sia delle valvole che separano le varie camere. La scelta dei materiali da usare è stata basata sui loro caratteri immunologici, biologici e biochimici. Dalle valvole di porco polverizzate sono state ottenute, con il metodo di frazionamento di Robert, cinque frazioni macromolecolari: proteine solubili, mucopolisaccaridi, glicoproteine strutturali, collagene solubile e insolubile, elastina. Lo studio delle proprietà antigeniche delle varie frazioni ha messo in luce il carattere antigenico delle prime tre. Per contro, il potere antigenico del collagene si è rivelato più debole e ha anche potuto essere ulteriormente ridotto per azione della glutaraldeide in soluzione tamponata a pH 7,4. Queste considerazioni hanno portato alla scelta del collagene. La superficie interna del cuore artificiale (trama sintetica) viene impregnata, mediante essiccazione a 80 °C, di collagene in soluzione acida, neutralizzato con vapori di ammonio, lavato con acqua distillata e poi stabilizzato mediante induzione di legami intermolecolari. Anche le valvole di tessuto vengono impregnate di collagene con lo stesso procedimento.
Le pompe centrifughe, studiate negli Stati Uniti, sono di piccolo diametro (cm 2,5) e hanno una velocità di rotazione di 4.000 giri, per una portata di 6 litri al minuto. Il loro rendimento è dell'ordine del 50% e la potenza totale fornita al motore della pompa è di 8 watt. Hanno la caratteristica di dare una pressione costante per qualunque portata. Il grado di emolisi è inferiore a 10 milligrammi per 100 litri di sangue pompato. La nocività di questo tipo di pompe nei confronti degli elementi figurati del sangue (globuli bianchi, globuli rossi) dipende dal fatto che la velocità periferica raggiunta dal sangue non oltrepassa i 5 metri al secondo, velocità che viene raggiunta nell'uomo al momento della massima eiezione dal ventricolo sinistro, in certe cardiopatie non emolizzanti. Alcuni problemi di coagulazione sulle palette della pompa sono in fase di soluzione. Attualmente queste pompe, usate in circolazione extracorporea con un ossigenatore, hanno permesso di ottenere sugli animali derivazioni complete del sangue per 36 ore.
b) La fonte di energia e il convertitore di energia.
Le diverse soluzioni che presentiamo sono state studiate da un'équipe diretta da P. Laurens, direttore delle ricerche presso l'INSERM.
1. La fonte di energia. - La maggior parte dei modelli in via di sperimentazione fa ancora oggi ricorso all'energia pneumatica trasmessa alla pompa collocata nel torace da tubi che ne attraversano la parete. I rischi di infezione sono evidenti.
L'ideale è avere in futuro una fonte di energia impiantabile all'interno dell'organismo e, se possibile, autonoma: queste due condizioni potrebbero essere raggiunte per mezzo dell'energia fornita da un radioisotopo.
Fonti di energia da radioisotopi di potenza fra 16 e 50 watt sono state innestate su animali negli Stati Uniti. Hanno dimostrato che la dispersione del calore attraverso il sangue e i tessuti è accettata anche per anni; le irradiazioni provocate da queste sorgenti si mantengono entro i limiti massimi sopportabili. I timori di una possibile diffusione del radioisotopo in caso di rottura delle capsule richiedono ancora uno studio molto approfondito delle guaine. L'uso dell'energia nucleare sarà possibile quando il rendimento reale dei convertitori termodinamici avrà raggiunto il 20%. L'energia fornita dalle pile a combustibile biologico è, invece, ancora lontana da potenze dell'ordine di un watt e si prevede che non saranno disponibili se non a lunga scadenza.
Al momento attuale non rimane, quindi, che la trasmissione dell'energia occorrente attraverso le pelle integra, come stadio iniziale. La trasmissione magnetica è sempre oggetto di studi, ma comporta un'apparecchiatura esterna assai pesante e ingombrante. La trasmissione elettromagnetica mediante radiofrequenze è stata sperimentata con successo. Per non costringere a un'alimentazione ininterrotta richiede un accumulatore che può essere di due tipi: l'accumulatore elettrico al nichel-cadmio, che ha un peso valutato intorno a kg 1,5 e deve essere ricaricato ogni tre ore, è in grado di alimentare il motore elettrico di un convertitore elettrodinamico o di una pompa centrifuga; l'accumulatore di calore, utilizzante una miscela eutettica fusa da una resistenza elettrica, ha un peso di circa un chilo e richiede la ricarica ogni otto ore.
Questi accumulatori, sia elettrici sia termici, hanno il vantaggio di poter fornire energia supplementare quando la pompa cardiaca ne ha bisogno per far fronte alla maggiore portata dovuta a uno sforzo.
2. Il convertitore di energia. - Trasforma l'energia di una fonte di calore o di elettricità in energia meccanica. Nel campo dei convertitori termodinamici uno dei cicli migliori divisati fino a oggi a questo scopo è il ciclo a elio di Stirling, da cui si spera di poter ottenere rendimenti fra il 16 e il 20%: É stato realizzato anche il ciclo a vapore di Rankine, ma le perdite fanno cadere il rendimento in modo tale che non si vede soluzione a breve termine.
Presso il centro di studi nucleari di Grenoble è stato realizzato un ciclo di rilassamento di Stirling che fornisce alla pompa un fluido pulsante in grado di assicurare portate uguali nel ventricolo destro e in quello sinistro. Può essere regolato automaticamente dalle variazioni delle resistenze periferiche o polmonari. In Francia non è stato realizzato alcun modello di questa apparecchiatura, mentre negli Stati Uniti sono stati realizzati cicli di questo tipo, ma meno perfezionati. Attualmente richiedono una potenza di ingresso di 40 watt, con un rendimento totale del 18%. Il miglioramento del rendimento, previsto a brevissimo termine, ridurrà la potenza di entrata occorrente a 25 watt.
I convertitori elettrodinamici usano un motore elettrico a corrente continua di alto rendimento con velocità di rotazione di 4.000 giri al minuto. Questi motori possono sia comprimere un fluido pulsante destinato ad azionare una pompa a membrana con un rendimento del 50%, sia azionare, mediante accoppiamento magnetico, una pompa centrifuga con migliore rendimento.
c) Il sistema di regolazione.
Il sistema di regolazione ha il compito di adattare la pompa cardiaca alle diverse condizioni circolatorie, entro i limiti fisiologici. Sono note alcune caratteristiche dell'adattamento dei ventricoli sinistro e destro. Se a monte aumenta l'afflusso di sangue, con aumento della pressione diastolica, il flusso cardiaco si accresce, e così pure se le resistenze periferiche e polmonari diminuiscono, come accade nel corso di uno sforzo. Queste facoltà di adattamento di un cuore normale alle variazioni del letto vascolare periferico sono notevoli. Sono state dimostrate nell'uomo, se non altro dopo i trapianti cardiaci totali o dopo il trascinamento elettrosistolico ottenuto con uno stimolatore cardiaco durante anni.
La pompa cardiaca artificiale deve dunque reagire in funzione delle condizioni che si riscontrano a monte e a valle, ma è stato anche dimostrato che, inversamente, i letti vascolari periferici entro certi limiti si adattano alle condizioni imposte da una pompa meccanica, come nel caso della circolazione extracorporea. Il cuore meccanico deve dunque mettere a profitto questa naturale facoltà di adattamento alle condizioni periferiche.
L'asservimento comprende tutta la catena (resistenze periferiche, pompa, convertitore, accumulatore di energia, fonte di energia) e non è possibile limitarlo a una sola frazione di essa. Questa regolazione può essere assicurata dal convertitore stesso, come nel caso del ciclo di rilassamento di Stirling, o da sensori alimentati dalla corrente elettrica. L'energia può essere fornita dall'accumulatore elettrico o da un convertitore termoelettrico derivato da quello degli stimolatori cardiaci a isotopi, nel caso di un accumulatore di calore. Nella sostituzione totale del cuore la regolazione più facile da ottenere è basata sulla variazione di portata delle due pompe, destra e sinistra, comandata automaticamente dalle variazioni delle resistenze periferiche.
d) Conseguenze applicative degli studi.
Si può prevedere che, assai prima della realizzazione di un cuore artificiale totalmente innestabile, da tutti i campi di ricerca potranno derivare varie applicazioni.
La soluzione dei problemi della prevenzione dei fenomeni di trombosi e di emolisi è direttamente applicabile ai sistemi di assistenza circolatoria prolungata e alle protesi valvolari. Se venissero messe a punto protesi valvolari affidabili sul lungo periodo, ne deriverebbe un'applicazione clinica immediata e generalizzata. La realizzazione di pompe centrifughe associate con un ossigenatore compatto a membrana apre la strada a circolazioni extracorporee prolungate nel tempo non emolizzanti. Il ‛cuore-polmoni' verrà collocato direttamente nel campo operatorio, sotto gli occhi del chirurgo, con una notevole riduzione delle tubature di raccordo e della quantità di sangue occorrente.
La tecnologia dei piccoli convertitori termodinamici o termoelettrici ad alto rendimento, della potenza dell'ordine del watt, risponde a una domanda importante nel campo delle trasmissioni, dell'oceanologia, delle ricerche petrolifere, della tecnica spaziale e dei perfezionamenti dei motori in generale. Lo studio di accumulatori elettrici stagni di grande capacità ma con ingombro ridotto risponde a ovvie esigenze delle industrie, quello di accumulatori di calore risponde alla domanda industriale di ambienti termostatati.
La trasmissione transcutanea dell'energia può essere usata anche in campi diversi dalla medicina, come nelle telemanipolazioni in ambienti stagni o inaccessibili. Anche ottenere plutonio 238 di grande purezza chimica e isotopica ha applicazioni fuori dal campo medico, per esempio nelle trasmissioni e nella tecnologia dei materiali spaziali.
Lo studio della regolazione ha un evidente interesse per una più approfondita conoscenza della fisiopatologia del cuore. Citiamo solo alcuni esempi di problemi, relativi al cuore umano, ancora poco conosciuti la regolazione della tensione arteriosa; l'equilibrio fra portata del cuore destro e del cuore sinistro; la regolazione della portata del cuore in funzione dei bisogni dell'organismo a riposo e sotto sforzo; la regolazione dell'ossigenazione in funzione della portata cardiaca; le modificazioni delle resistenze periferiche in funzione dei diversi stati fisiologici e patologici.
Insomma, anche se la realizzazione di un cuore artificiale totalmente innestabile non è prevista che in un futuro lontano, i molti studi che vi conducono hanno in ogni stadio della ricerca conseguenze applicative in campo medico e industriale tali da richiederne la prosecuzione.
e) Ricerche sperimentali.
Nel corso degli anni i risultati delle sperimentazioni danno prova di regolari progressi: l'ultimo nel tempo è la sopravvivenza di un vitello per sei mesi. Nel 1971 si perseguiva l'obiettivo di conservare vivo l'animale per 100 ore. Sette anni dopo cinque diversi laboratori potevano attestare che 15 animali erano sopravvissuti per 100 giorni o più, dopo la sostituzione totale del cuore con un cuore artificiale mosso da energia pneumatica. In effetti gli sforzi dei ricercatori sono stati soprattutto volti alla realizzazione del modello più adatto, quanto al rivestimento interno delle pareti e delle valvole, senza preoccuparsi di una fonte di energia innestabile nè di un sistema di regolazione sofisticato. È però importante sottolineare che il fallimento dell'esperimento di Lawson, sopravvenuto dopo sei mesi di sopravvivenza dell'animale, ebbe come cause una stenosi fibrosa interna, che riduceva il calibro utile degli orifizi atrioventricolari, e insieme la fissurazione multipla del rivestimento interno della protesi, con formazione di numerosi coaguli.
Nonostante il carattere limitativo di questi risultati, nel dicembre del 1982 a Salt Lake City è stato praticato l'innesto di un cuore artificiale in un uomo di 61 anni affetto da una miocardiopatia giunta all'ultimo stadio di evoluzione.
La protesi utilizzata era la variante n. 7 di R. K. Jarvik, mossa dall'energia pneumatica fornita da un compressore esterno montato su carrello. Poiché non è stata fornita alcuna informazione medica sul materiale di rivestimento nè sul tipo di valvole artificiali usato, e neppure sulle condizioni in cui l'operazione è stata decisa, sembra impossibile impostare qui un esame critico di questo esempio di accanimento terapeutico.
Alcuni la considerano una tappa necessaria, nonostante il suo carattere di incompiutezza, verso un cuore artificiale totalmente innestabile, altri la giudicano un'estensione della sperimentazione che da questo punto viene praticata sull'uomo, con tutte le riserve e le controversie che questo exploit tecnologico può suscitare sul piano etico. Si possono prevedere nuove applicazioni di questa tecnica, soprattutto nei malati di 50 anni e oltre che mal si prestano ai trapianti cardiaci (cfr. Jarvik, in Dubost, 1984).
10. L'assistenza cardiocircolatoria.
Vi sono circostanze patologiche in cui un malato o un operato possono aver bisogno, per un periodo di tempo variabile, di un sostegno cardiocircolatorio meccanico o biologico che lo aiuti a superare un momento critico, a condizione che le cause dell'insufficienza siano reversibili.
a) Assistenza con palloncino pulsante intra-aortico.
Basi sperimentali. - Nel 1953 A. Kantrowitz praticò sperimentalmente un'anastomosi fra un'arteria periferica e un'arteria coronaria attraverso un catetere la cui lunghezza era calcolata in modo che l'onda della pressione sistolica raggiungesse il letto coronario durante la diastole, e osservò che, a parità di lavoro utile del cuore, si aveva un incremento del 25-30% del flusso delle coronarie. Questi risultati furono confermati da G. O. Casten, che dimostrò l'aumento relativo del flusso nel seno venoso coronario in presenza di derivazioni veno-arteriose a reiniezione diastolica; nel 1958 Kantrowitz propose una tecnica di assistenza cardiaca che prefigurava la contropulsione (v. Kantrowitz e altri, 1968; v. Moulopoulos e altri, 1962).
D. E. Harken, nel 1958, definì le basi della contropulsione arterio-arteriosa, per la quale venne presentata una prima apparecchiatura nel 1961. Nella versione iniziale la contropulsione si serviva di un ventricolo artificiale extracorporeo funzionante in alternanza sincronizzata con il ventricolo sinistro. Per mezzo di una cannula arteriosa una quantità di sangue corrispondente alla totalità o a una parte del volume di eiezione dal ventricolo sinistro veniva aspirata nel ventricolo extracorporeo nel momento della sistole ventricolare e reiniettata nel letto arterioso durante la diastole. Questa reiniezione diastolica restituisce alla rete arteriosa, durante il riposo ventricolare, la quantità di sangue sottratta e, aumentando la pressione diastolica nell'aorta, favorisce la perfusione coronarica nel momento in cui sono minori le resistenze coronariche.
A quel tempo, però, vi erano notevoli limitazioni nell'uso di una cannula in un'arteria periferica e di un ventricolo extracorporeo, e perciò poco a poco la contropulsione per derivazione extracorporea cadde in discredito nonostante alcuni rapporti clinici incoraggianti.
Nel 1962 S. D. Moulopoulos (v. Moulopoulos e altri, 1962) propose l'uso di un pallone intra-aortico per realizzare, senza traumi per il sangue, gli scopi teorici della contropulsione, ma solo dopo vari anni di studi sperimentali e di perfezionamenti tecnici successivi la contropulsione diastolica per mezzo del pallone intra-aortico fu usata per la prima volta clinicamente (da Kantrowitz e i suoi collaboratori) e nelle unità di rianimazione cardiaca.
Tecnica. - La tecnica consiste nell'introdurre attraverso un'arteria femorale un palloncino gonfiabile, di forma molto allungata e di capacità compresa fra 20 e 40 cm3, montato all'estremità di un catetere che viene spinto fino alla parte iniziale dell'aorta toracica discendente. Attraverso il catetere il palloncino è collegato a una sorgente esterna di gas (elio o CO2) ed è gonfiato e sgonfiato con un ritmo sincronizzato in base all'elettrocardiogramma. Durante la diastole ventricolare il gonfiarsi del palloncino aumenta la pressione diastolica nell'aorta, che è la pressione di elezione della perfusione coronarica, e spinge il sangue dell'aorta verso le arterie periferiche. Il palloncino viene sgonfiato subito prima dell'eiezione ventricolare sinistra; la relativa vicinanza del palloncino alle valvole dell'aorta e il breve intervallo di tempo fra il suo sgonfiamento e l'eiezione ventricolare costituiscono le migliori garanzie che l'eiezione ventricolare avvenga in un'aorta ‛vuota'.
Risultati. - La nostra esperienza, ancora recente, ha permesso di mettere l'accento sull'efficacia del metodo in due gravissime complicazioni dell'infarto: la comunicazione interventricolare per rottura del setto e l'insufficienza mitralica per rottura dei muscoli papillari.
Ci è così stato possibile operare precocemente un piccolo gruppo di malati, permettendo loro di attendere il momento dell'intervento grazie alla contropulsione e successivamente di essere ancora aiutati nelle prime fasi postoperatorie da qualche giorno di circolazione assistita.
b) Assistenza mediante cuore-polmoni artificiale.
Oggi, con le pompe e gli ossigenatori convenzionali, non si può assicurare l'assistenza circolatoria a un malato per più di qualche ora, mentre si sente invece il bisogno di periodi di assistenza sempre più lunghi, specialmente quando si tratta di superare momenti critici della durata di vari giorni, provocati da disordini non solo cardiaci ma soprattutto polmonari, e in modo particolarmente acuto soprattutto nel periodo postoperatorio di alcune cardiopatie congenite. Gli ossigenatori a gorgogliamento, i più usati, risultano traumatizzanti per gli elementi figurati del sangue e non possono funzionare validamente per più di qualche ora.
La necessità di ossigenatori monouso, che possano venire impiegati per vari giorni senza alterare gli elementi del sangue e garantendo una buona ossigenazione e l'estrazione del CO2, è dunque un imperativo assoluto.
La parte essenziale del lavoro di ricerca svolto da una decina di anni è la messa a punto di un ossigenatore a membrana che permetta di supplire alla funzione respiratoria evitando il contatto diretto del sangue con la fase gassosa e in cui gli scambi avvengano attraverso una membrana che pertanto dev'essere contemporaneamente dotata di una resistenza meccanica sufficiente e di una elevata permeabilità ai gas (O2 e CO2) con scambi dello stesso ordine di grandezza, tenuto conto dei gradienti di pressioni parziali molto differenti.
Questo ossigenatore dev'essere di tipo modulare, in modo da mettere a disposizione una superficie di membrana predeterminata secondo i bisogni; lo strato di sangue deve risultare quanto più sottile possibile per garantire gli scambi più efficaci (attualmente esistono vari modelli di ossigenatori a membrana monouso: v. cap. 2). Il circuito di assistenza, di cui il polmone a membrana è l'elemento essenziale, deve evitare il traumatismo del sangue, rispettare le condizioni circolatorie ottimali di funzionamento dell'ossigenatore e ridurre o compensare le perdite di calore.
Il funzionamento di un'assistenza cardiorespiratoria di questo tipo richiede la sorveglianza di numerosi parametri circolatori e respiratori, la conservazione nel sangue di una ipocoagulabilità richiesta dall'impiego di materiali extracorporei, il rispetto dell'equilibrio acido-base e il controllo delle funzioni renali, per non citare che le esigenze fondamentali.
La derivazione veno-arteriosa garantisce il funzionamento cardiaco e lo completa se insufficiente; l'ossigenazione extracorporea è resa necessaria dalla portata ridotta del cuore e dalla presenza frequente di lesioni polmonari.
Per il momento è difficile valutare l'opportunità delle indicazioni delle derivazioni cardiocircolatorie di lunga durata. Alcune équipes hanno ottenuto successi, ma sono ancora poche unità.
c) Ventricolo sinistro ausiliario.
L'associazione di una pompa e di un ossigenatore può non essere necessaria in alcuni casi, in particolare quelli in cui l'insufficienza acuta del ventricolo sinistro, conseguente a un'operazione sulle valvole cardiache o sulle coronarie, può risultare reversibile; in queste condizioni una pompa ausiliaria che scarichi parzialmente il ventricolo sinistro dovrebbe permettere di superare il momento critico e restituire al ventricolo la sua capacità di contrazione.
In questa direzione lavorano da tempo numerose équipes, soprattutto americane; DeBakey, a Houston, ha messo a punto, in particolare, una pompa sferica di silastic rinforzato con dacron, in cui un diaframma mediano divide l'emisfero riservato al sangue da quello in cui viene immessa anidride carbonica sotto pressione per comprimere ritmicamente la membrana di separazione e distribuire il sangue all'aorta o a una delle sue derivazioni.
Questa pompa, completamente esterna al corpo del paziente, è connessa con l'atrio sinistro per mezzo di un tubo munito di valvola introdotto attraverso uno spazio intercostale, mentre il volume di sangue che ha riempito l'emisfero della pompa viene inviato nell'aorta o in una delle sue derivazioni per mezzo di un altro tubo munito di valvola, suturato sull'arteria prescelta.
L'idea è seducente, ma senza dubbio più teorica che pratica, perchè la pompa va incontro alle stesse difficoltà del cuore meccanico artificiale. Essa rende necessaria una toracotomia, operazione che comporta di per sé un potenziale di gravità poco raccomandabile nel caso di un malato che ha bisogno di un soccorso immediato per mezzo di un intervento chirurgico semplice e rapido: perciò in questo campo l'assistenza circolatoria mediante palloncino pulsante intra-aortico resta ancora il mezzo più largamente usato. C'è tuttavia una recente semplificazione che può essere applicata con facilità agli operati a torace aperto: la messa in opera di un by-pass pulsante fra atrio sinistro e arteria femorale; la regolazione della pompa interposta permette di calibrare la portata in modo sufficiente ad alleviare il compito del ventricolo sinistro.
11. Gli stimolatori cardiaci.
I malati che beneficiano della messa in opera di uno stimolatore cardiaco sono quelli colpiti da un blocco atrioventricolare congenito o acquisito, postoperatorio.
Le speranze riposte nella pila a isotopi di P. Laurens (del 1970) non hanno trovato conferma. Il volume notevole e il sistema elettronico non programmabile hanno contribuito a farne sospendere la produzione a vantaggio degli stimolatori al litio, sia iodato sia al biossido di manganese, che hanno una durata di funzionamento compresa fra 10 e 15 anni. La miniaturizzazione ha contribuito alla loro popolarità. Oggi la grande maggioranza di questi stimolatori viene messa in opera senza bisogno di una toracotomia, grazie all'introduzione per via venosa, in anestesia locale, di un elettrodo speciale con un terminale rugoso che gli permette di restare incastrato nella muscolatura del ventricolo. Questo non è l'unico progresso tecnico di cui si sono avvantaggiati gli stimolatori cardiaci: le nuove possibilità offerte dall'elettronica permettono di raccogliere informazioni dagli atri e dai ventricoli, in modo da poter stimolare l'una o l'altra di queste cavità, armonizzando gli stimoli se occorre; ultima realizzazione, lo stimolatore che si adatta allo sforzo aumentando il ritmo in funzione dei bisogni del portatore.
Altro vantaggio: la fotoanalisi permette di analizzare i diversi parametri dello stimolatore e di modificarne gli elementi senza bisogno di estrarre la scatola dal torace. Infine, se è necessario, è disponibile un altro espediente tecnico: un pacemaker installato per via operatoria può essere munito di un allarme che in caso di tachicardia o di fibrillazione ventricolare comanda uno shock elettrico che garantisce il ritorno alla norma delle contrazioni anarchiche del miocardio.
Non vi è dubbio che il cammino percorso negli ultimi venticinque anni ha seguito i progressi compiuti nel campo dell'elettronica: miniaturizzazione, automatizzazione, funzionamento su richiesta sono le caratteristiche degli stimolatori cardiaci moderni. Il contributo medico più importante è rappresentato dalla messa in opera degli elettrodi per semplice via venosa. (Per una bibliografia esauriente v. Schechter, 1983).
Bibliografia.
Allaines, F. d', Blondeau, Ph., Dubost, Ch., À propos de 100 commissurotomies mitrales, in ‟Mémoires de l'Académie de Chirurgie", 1953, LXXIX, pp. 572-581.
Allaines, F. d', Heim de Balsac, R., Dubost, Ch., Scebat, L., Prileux, C., Allary, M., Essai de traitement des cardiopathies décompensées par la ligature de la veine cave inférieure, in ‟Mémoires de l'Académie de Chirurgie", 1949, LXXV, pp. 791-799.
Allaines, F. d', Lenegre, J., Mathivat, A., Scebat, L., Dubost, Ch., Rétrécissement mitral. Anastomose veine pulmonaire-veine azygos. Premier cas opéré, in ‟Archives des maladies du coeur", 1949, XLII, pp. 456-461.
Barnard, Ch., A human cardiac successful transplantation performed at Groote Schuur Hospital, Capetown, in ‟South African medical journal", 1967, XLI, pp. 1271-1274.
Barratt-Boyes, b. g., Lowe, J. B., Cole, D. S., Kelly, D. T., Homograft replacement for aortic valve disease, in ‟Thorax", 1965, XX, pp. 495-504.
Berg, J. R., Selinger, S. L., Leonrd, J. J., O'Grady, W. P., Immediate coronary artery bypass for acute evolving myocardial infarction, in ‟Journal of thoracic and cardiovascular surgery", 1981, LXXXI, pp. 493-497.
Binet, J. P., État actuel des prothèses et des greffes valvulaires cardiaques, in Rapport du 70ème Congrès de l'Association Française de Chirurgie, Paris 1968, pp. 535-574.
Binet, J. P., Progrès récents en chirurgie cardiaque pédiatrique, in ‟Le journal des Agrégés", 1981, XIV, 4, pp. 171-178.
Binet, J. P., Bruniaux, J., Langlois, J., Planché, Cl., Conso, J.F., Leriche, H., Pottemain, M., Hvass, U., Fermeteure de première intention des C.I.V. mal tolérées chez le nourrisson, in ‟Chirurgie pédiatrique", 1980, XXI, pp. 7-13.
Binet, J. P., Carpentier, A., Langlois, J., Clinical use of heterografts for replacement of the aortic valve, in ‟Journal of thoracic and cardiovascular surgery", 1968, LV, pp. 238-242.
Binet, J. P., Carpentier, A., Langlois, J., Duran, C., Corvez, P., Implantatin de valves hétérogènes dans le traitement des cardiopathies aortiques, in ‟Comptes rendus de l'Académie des Sciences. Paris", 1965, CCLXI, pp. 5733-5734.
Binet, J. P., Carpentier, A., Langlois, J., Leiva-Semper, A., L'utilisation des homo- et hétérogreffes dans le remplacement de l'appareil aortique chez l'homme, in ‟Archives des maladies du coeur et des vaisseaux", 1966, LIX, 10, pp. 1570-1572.
Binet, J. P., Duran, C., Carpentier, A., Langlois, J., Heterologous aortic valve transplantation, in ‟Lancet", 1965, II, pp. 1275-1278.
Binet, J. P., Patane, L., Nottin, R., Correction of tetralogy of Fallot by combined transatrial and pulmonary approach, in Pediatric cardiology and cardiosurgery, vol. XXII, Basel 1983, pp. 152-156.
Binet, J. P., Planché, Cl., Langlois, J., Conso, J. F., Reconstitution de la voie d'éjection du ventricule droit à l'aide de tubes valvés, in ‟La nouvelle presse médicale", 1972, VIII, pp. 541-542.
Binet, J. P., Pottemain, M., Langlois, J., Bruniaux, J., Planché, Cl., Weiss, M., Nicolas, F., Expérience du centre chirurgical Marie-Lannelongue sur l'hypothermie profonde cehz le nourrisson et l'enfant (de 8 jours à 3 ans 1/2), in ‟Annales de pédiatrie", 1981, XXVIII, 1, pp. 41-43.
Björk, V. O., Olin, C. L., Bjarke, B. B., Thoren, C. A., Right atrial-right ventricular anastomosis for correction of tricuspid atresia, in ‟Journal of thoracic and cardiovascular surgery", 1979, LXXVII, pp. 452-458.
Blalock, A., Taussig, H. B., The surgical treatment of malformation of the heart in which there is pulmonary stenosis, in ‟Journal of the American Medical Association", 1945, CXXVIII, pp. 189-202.
Blondeau, Ph., Allaines, Cl. d', Piwnica, A., Carpentier, A., Soyer, R., Dubost, Ch., Traitement chirurgical de la communication interauriculaire isolée (ostium secundum) après 50 ans. Résultats immédiats et lontains. Étude d'une série de 57 observations, in ‟Annales de chirurgie thoracique et cardio-vasculaire", 1975, XIV, 1, pp. 1-9.
Borel, J. F., Feurer, C., Magree, C., Stahelin, H., Effects of a new antilymphocytic peptide - Cyclosporin A - in animals, in ‟Immunology", 1977, XXXII, pp. 1017-1025.
Bourassa, M. G., Campeau, L., Lesperance, J., Grondin, C. M., Changes in graft and coronary arteries after saphenous vein aorto-coronary bypass surgery: results at repeat angiography, in ‟Circulation", 1982, LXV, pp. 90-97.
Bruniaux, J., Weiss, M., Binet, J. P., Extracorporeal circulatory assistance with a membrane oxygenator. The experience of the Marie-Lannelongue group, in ‟Acta cardiologica", 1982, XXVIII, suppl., pp. 103-110.
Bruschke, A. V., Proudfit, W. L., Sones, P. M., Natural history of obstructive coronary artery disease: ten years study of 601 non surgical cases, in ‟Progress in cardiovascular diseases", 1978, XXI, pp. 53-78.
Bulkley, B. H., Hutchins, G. M., Myocardial consequences of coronary bypass graft surgery. The paradox of necrosis in areas of revascularization, in ‟Circulation", 1977, LVI, pp. 906-913.
Burggraf, G. W., Parker, J. O., Prognosis in coronary artery disease, in ‟Circulation", 1975, LI, pp. 146-156.
Calne, R. Y., White, D. J., Rolles, K. e altri, Prolonged survival of pigs orthotopic heart grafts treated with Cyclosporin A, in ‟Lancet", 1977, I (8075), pp. 1183-1185.
Camilleri, J., Pornin, B., Carpentier, A., Structural changes of glutaraldehyde treated porcine bioprosthesis valves, in ‟Archives of pathology and laboratory medicine", 1982, CVI, pp. 490-496.
Carpentier, A., La valvuloplastie reconstitutive. Une nouvelle technique de valvuloplastie mitrale, in ‟La presse médicale", 1969, LXXVII, 7, pp. 251-253.
Carpentier, A., The concept of bioprosthesis, in Thoraxchirurgie, vasculäre Chirurgie, vol. XIX, 5, Stuttgart 171.
Carpentier, A., Discussion Long-term experience with porcine aortic valve xenografts'. E. B. Stinson, R. B. Griepp, P. E. Oyer, N. E. Shumway, in ‟Journal of thoracic and cardiovascular surgery", 1977, LXXIII, 1, pp. 54-63.
Carpentier, A., Le coeur artificiel. Mythe ou réalité, in Compte-rendu des entretiens de Bichat, Paris 1980.
Carpentier, A., Hétérogreffes et bioprothèses valvulaires (1965-1981), in Proceedings des Instituts de Recherche Servier Mercredis Jean Lenègre' (3 juin 1981), Paris 1981, pp. 1-9.
Carpentier, A., The artificial heart. Clinical indications and socioeconomic implications, in ‟Artificial organs", 1981, V, suppl.
Carpentier, A., Cardiac valve surgery: the French correction, in ‟Journal of thoracic and vascular surgery", 1983, LXXXVI, pp. 323-337.
Carpentier, A., Blondeau, Ph., Laurens, P., Hay, A., Laurent, D., Dubost, Ch., Mitral and tricuspid valve replacement with framemounted aortic heterografts, in ‟Journal of thoracic and cardiovascular surgery", 1968, LVI, 3, pp. 388-394.
Carpentier, A., Chanard, J., Briotet, J. M., Harada, H., Archundia, H., Salamagne, J. C., Vigano, M., Laurens, P., Laurent, D., Dubost, Ch., Remplacement de l'appareil valvulaire mitral par des hétérogreffes hétérotopiques, in ‟La presse médicale", 1967, LXXV, 31, pp. 1603-1606.
Carpentier, A., Chanard, J. C., Laurens, P., Guery, J., Harada, H., Laurent, D., Dubost, Ch., Utilisation d'hétérogreffes aortiques dans le traitement des valvulopathies mitrales. Bases expérimentales et premier cas clinique, in ‟Mémoires de l'Académie de Chirurgie", 1967, XCIII, 19-21, pp. 617-622.
Carpentier, A., Chauvaud, S., Fabiani, J. N., Deloche, A., Relland, J., Lessana, A., Allaines, Cl. d', Blondeau, Ph., Piwnica, A., Dubost, Ch., Reconstructive surgery of mitral valve incompetence tenyear appraisal, in ‟Journal of thoracic and cardiovascular surgery", 1980, LXXIX, 3, pp. 338-348.
Carpentier, A., Deloche, A., Dauptain, J., Soyer, R., Prigent, Cl., Blondeau, Ph., Piwnica, A., Dubost, Ch., A new reconstructive operation for correction of mitral and tricuspid insufficiency, in ‟Journal of thoracic and cardiovascular surgery", 1971, LXI, 1, pp. 1-13.
Carpentier, A., Deloche, A., Hanania, G., Forman, J., Sellier, Ph., Piwnica, A., Dubost, Ch., Surgical management of acquired tricuspid valve disease, in ‟Journal of thoracic and cardiovascular surgery", 1974, LXVII, 1, pp. 53-65.
Carpentier, A., Dleoche, A., Lessana, A., Prigent, Cl., Beuzelin, J. P., Carpentier, S., Guerin, L., Macher, J. P., Touchot, B., Baron, P., Danan, M., Dubost, Ch., Collagen-derived heart valves. Concept and experimental results, in ‟Journal of thoracic and cardiovascular surgery", 1971, LXII, 5, pp. 703-713.
Carpentier, A., Deloche, A., Prigent, Cl., Beuzelin, J. P., Lessana, A., Salamagne, J. C., Guerin, L., Danan, M., Bedrane, Z., Carpentier, S., Baron, M., Macher, J. P., Dubost, Ch., Utilisation de biopolymères dans la construction de prothèses valvulaires cardiaques, in ‟Comptes rendus de l'Académie des Sciences. Paris", 1971, CCLXXII, pp. 178-179.
Carpentier, A., Deloche, A., Relland, J., Fabiani, J. N., Forman, J., Camilleri, J. P., Soyer, R., Dubost, Ch., Six years follow-up of gluraraldehyde-preserved heterografts. With particular reference to the treatment of congenital valve malformations, in ‟Journal of thoracic and cardiovascular surgery", 1974, LXVIII, 5, pp. 771-782.
Carpentier, A., Dubost, Ch., Allografts and xenografts as valvular substitute, in Human organ support and replacement. Transplantation and artificial prosthesis (a cura di J. D. Hardy e Ch. Thomas), Springfield, Ill., 1971, pp. 332-362.
Carpentier, A., Dubost, CH., Lane, E., Nashef, A., Carpentier, S., Relland, J., Deloche, A., Fabiani, J. N., Chauvaud, S., Perier, P., Maxwell, S., Continuing improvements in valvular bioprosthesis, in ‟Journal of thoracic and cardiovascular surgery", 1982, LXXXXIII, pp. 27-42.
Carpentier, A., Lemaigre, G., Robert, L., Carpentier, S., Dubost, Ch., Biological factors affecting long-term results of valvular heterografts, in ‟Journal of thoracic and cardiovascular surgery", 1969, LVIII, pp. 467-483.
Carpentier, A., Nashef, A., Carpentier, S., Goussef, N., Ahmed, A., Jones, M., Techniques preventing calcification of valvular bioprosthesis, in ‟Circulation", 1984, LXX, suppl. 1, pp. 165-168.
Carpentier, A., Perier, P., Lane, E., Deloche, A., Dubost, Ch., A new valvular bioprosthesis, in ‟Proceedings of the European Society for Artificial Organs", 1981, VIII, pp. 100-102.
Carpentier, A., Piekarski, A., Le coeur artificiel, in ‟Le concours médical", 1983, CV, 32, pp. 3364-3365.
Carpentier, A., Relland, J., Deloche, A., Fabiani, J. N., Lessana, A., Cour, J. C., Schahmaneche, L., Gory, R., Myon, M., Prigent, Cl., Dubost, CH., Biopolymers as antithrombogenic inducing factor in the construction of cardiac valves and artificial heart, in ‟Proceedings of the European Society for Artificial Organs", 1974, I, pp. 24-26.
Carpentier, S., Prévention des calcifications des bioprothèses valvulaires, in ‟L'information cardiologique", 1983, VII, pp. 637-738.
Chauvaud, S., Carpentier, A., Chirurgie reconstructrice de l'insuffisance mitrale acquise de l'enfant, in ‟Archives des maladies du coeur", 1980, LXXIII, pp. 1365-1372.
Chesbro, J. H., Clements, J. P., Fuster, V. e altri, A latelet inhibition drug trial in coronary artery by pass operations, in ‟New England journal of medicine", 1982, CCCVII, pp. 73-78.
Conti, C. R., Hodges, M., Hutter, A. e altri, Unstable angina pectoris: national cooperative study group to compare surgical and medical therapy in hospital experience, in ‟Cardiovascular clinics", 1977, VIII, pp. 167-178.
Cooley, D. A., Bloodwell, R. D., Beall, A. C. e altri, Surgical management of aneurysms of aortic arch, in ‟Surgical clinics of North-America", 1966, XLVI, pp. 1033-1044.
Copeland, J. G., Stinson, E. B., Human heart transplantation, in ‟Current problems in cardiology", 1979, IV, 8, pp. 1-5.
Cosgrove, D. M., Loop, D. F., Sheldon, W. C. e altri, Results of myocardial revascularization, in ‟Circulation", 1982, LXV, pp. 11-37.
Crafoord, C., Nylin, G., Congenital coarctation of the aorta and its surgical treatment, in ‟Journal of thoracic surgery", 1945, XIV, pp. 347-361.
Crawford, S., Schuessler, J. S., Thoraco-abdominal aortic aneurism involving coeliac, superior mesenteric, and renal arteries, in ‟World journal of surgery", 1980, IV, pp. 643-651.
DeBakey, M. E., Cooley, D. A., Successful resection of aneurysm of thoracic aorta and replacement by graft, in ‟Journal of the American Medical Association", 1953, CLII, pp. 673-676.
Deloche, A., Carpentier, A., Fabiani, J. N., Piwnica, A., Guermonprez, J. L., Ecoiffier, J., Diamant-Berger, F., Haas, Cl., Soyer, R., Eisenmann, B., Lozano, R., Dubost, Ch., Traitement chirurgical de l'insuffisance coronarienne aiguë (à propos de 100 cas), in ‟Coeur", 1975, VI, 1, pp. 41-64.
Deloche, A., Carpentier, A., Hanania, G., Fabiani, J. N., Lessana, A., Dubost, Ch., Annuloplastie reconstitutive tricuspidienne (à propos de 250 patients), in ‟Coeur", 1975, n. speciale, pp. 673-680.
Deloche, A., Lacour-Gayet, F., Allaines, Cl. d', Blondeau, Ph., Crpentier, A., Dreyfus, G., Fabiani, J. N., Piwnica, A., Ribeiro, E. J., Becquemin, J. P., Massoud, H., Vaudron, E., Dubost, Ch., Traitement chirurgical du prolapsus par dégénérescence valvulaire. À propos de 125 patients, in ‟Coeur", 1980, XI, 3, n. speciale, pp. 973-979.
Deloche, A., Perier, P., Bourezak, H., Chauvaud, S., Donzeau-Gouge, P., Dreyfus, G., Fabiani, J. N., Massoud, H., Carpentier, A., Dubost, Ch., A 14-years experience with valvular bioprostheses: valve survival and patient survival, in Cardiac bioprostheses (a cura di L.H. Cohn e V. Galluci), New York 1983.
De Wall, R. A., Warden, H. E., Varco, R. L., Lillehei, C. W., The helix reservoir pump-oxygenator, in ‟Surgery, gynecology and obstetrics", 1957, CIV, pp. 699-710.
Donzelot, E., Allaines, F. d', Traité des cardiopathies congénitales, Paris 1953.
Doty, D. B., Marvin, W. J., Laver, R. M., Modified Fontan procedure, in ‟Journal of thoracic and cardiovascular surgery, 1981, LXXXI, pp. 470-475.
Dubost, Ch., Mitral stenosis and mitral insufficiency, in Henry Ford hospital international symposium on cardiovascular surgery, Detroit 1955, Philadelphia 1955, pp. 205-211.
Dubost, Ch., Chirurgie de la tétralogie de Fallot, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1962, I, pp. 752-753.
Dubost, Ch., Réparation complète de la tétralogie de Fallot à propos de 112 observations. Techniques, indications, résultats, in ‟Archives des maladies du coeur et des vaisseaux", 1964, LVII, 4, pp. 485-501.
Dubost, Ch., Scientific and ethical problems in organ transplantation, in ‟The annals of thoracic surgery", 1969, VIII, 2, pp. 95-103.
Dubost, Ch., La transplantation du coeur, in ‟Bulletin de l'Académie Nationale de Médecine", 1970, CLIV, pp. 615-620.
Dubost, Ch., Heart transplantation and artificial heart, in ‟Transplantation proceedings", 1974, VI, pp. 31-35.
Dubost, Ch. (a cura di), Vivre avec le coeur d'un autre, in Académie de médecine. Vivre pleinement malgré sa maladie, vol. I, Paris 1984.
Dubost, Ch., Allaines, Cl. d', Les possibilités actuelles de la chirurgie cardiaque sous hypothermie, in ‟Journal de chirurgie", 1955, LXXI, pp. 285-300.
Dubost, Ch., Allaines, Cl. d', Blondeau, Ph., La chirurgie des lésions tricuspidiennes acquises dans le cadre des lésions polyvalvulaires, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1971, VII, pp. 555-564.
Dubost, Ch., Allaines, Cl. d', Blondeau, Ph., Carpentier, A., Le Guillot, M., La fermeture par le ventricule gauche des perforations du septum interventriculaire après infarctus du myocarde, in ‟Archives des maladies du coeur et des vaisseaux, 1968, LXI, 12, pp. 1785-1792.
Dubost, Ch., Allaines, Cl. d', Blondeau, Ph., Piwnica, A., Carpentier, A., Soyer, R., Résultats à long terme des prothèses valvulaires aortiques, in ‟Archives des maladies du coeur et des vaisseaux", 1973, LXVI, 4, pp. 515-528.
Dubost, Ch., Allaines, Cl. d', Tuffier, J., Passelecq, J., Madier, C., Latscha, I., Les possibilités d'assèchement des cavités cardiaques par l'hexamethonium et le clampage simultané des veines caves. Essais de chirurgie intra-cardiaque à vue directe, in ‟Mémoires de l'Académie di Chirurgie", 1952, LXXVIII, pp. 307-312.
Dubost, Ch., Allaines, F. d', Du Bouchet, N., Le Brigand, J., Notes complémentaires sur 37 cas d'opération de Blalock-Taussig, in ‟Mémoires de l'Académie de Chirurgie", 1948, LXXIV, pp. 679-686.
Dubost, Ch., Allary, M., Oeconomos, N., À propos du traitement des anévrysmes de l'aorte. Ablation de l'anévrysme et rétablissement de la continuité par greffe d'aorte humaine conservée, in ‟Mémoires de l'Académie de Chirurgie", 1951, LXXVII, pp. 381-383.
Dubost, Ch., Allary, M., Oeconomos, N., Resection of an aneurysm of the abdominal aorta. Reestablishment of the continuity by a preserved human arterial graft with result after five months, in ‟A.M.A. Archives of surgery", 1952, LXIV, pp. 405-408.
Dubost, Ch., Blondeau, Ph., Chirurgie à coeur ouvert, Paris 1957.
Dubost, Ch., Blondeau, Ph., 167 interventions à coeur ouvert sous circulation extra-corporelle pour cardiopathie congénitale, in ‟Presse médicale", 1959, LXVII, pp. 1865-1966.
Dubost, Ch., Blondeau, Ph., La place de la circulation extra-corporelle dans le traitement des cardiopathies congénitales. À propos de 124 interventions, in ‟Mémoires de l'Académie de Chirurgie", 1959, LXXXV, pp. 363-377.
Dubost, Ch., Blondeau, Ph., The association of the artificial heartlung with deep hypothermia in open heart surgery, in ‟Journal of cardiovascular surgery", 1960, I, pp. 85-93.
Dubost, Ch., Blondeau, Ph., Cure chirurgicale de 2 cas de coronarite ostiale syphilitique, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1962, I, pp. 802-806.
Dubost, Ch., Blondeau, Ph., Allaines, Cl. d', Piwnica, A., Carpentier, A., Soyer, R., Chaouche, M., Brunet, A., Thrombose massive de l'oreillette gauche. À propos d'une série chirurgicale de 76 cas, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1977, XVI, 1, pp. 45-50.
Dubost, Ch., Blondeau, Ph., Cachera, J. P., Correction chirurgicale directe de la maladie d'Ebstein: 4 cas operés avec succès, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1968, VII, pp. 11-21.
Dubost, Ch., Blondeau, Ph., Guilmet, D., Replacement of cardiac valves in man, in ‟Journal of cardiovascular surgery", 1966, suppl., pp. 104-110.
Dubost, Ch., Blondeau, Ph., Lenfant, C., Weiss, M., Piwnica, A., Passelecq, J., Guery, J., Sprovieri, L., 44 interventions à coeur ouvert sous circulation extra-corporelle, in ‟Semaine des hôpitaux de Paris", 1958, XXXIV, pp. 431-442.
Dubost, Ch., Blondeau, Ph., Piaux, C., Lenfant, C., Passelecq, J., Guery, J., Le Brigand, H., wapler, C., Weiss, M., Fermeture d'une communication interventriculaire à coeur ouvert sous circulation extracorporelle. Premier succès français, in ‟Mémoires de l'Académie de Chirurgie", 1956, LXXXII, pp. 207-216.
Dubost, Ch., Blondeau, Ph., Piwnica, A., Chirurgie cardiaque sous contrôle de la vue (à propos de 600 cas), in ‟Mémoires de l'Académie de Chirurgie", 1960, LXXXVI, pp. 146-156.
Dubost, Ch., Cachera, J. P., Un cas de greffe allogénique du coeur chez l'homme compatible dans le système HLA et traitée par une globuline antilymphocytaire hétérologue, in ‟Presse médicale", 1968, LXXVI, pp. 1651-1654, 1613-1716.
Dubost, Ch., Cachera, J. P., A human case of allogenic heart transplantation compatible in the HLA system and treated by a heterologous anti-lymphocyte globuline, in ‟Transplantation proceedings", 1969, I, pp. 693-702.
Dubost, Ch., Chachera, J. P., Problèmes scientifiques dans les greffes d'organes, in ‟Cahiers du College de Médecine", 1969, X, pp. 1047-1053.
Dubost, Ch., Cachera, J. P., Trois cas de greffe allogénique du coeur chez l'homme, in ‟Archives des maladies du coeur et des vaisseaux", 1969, LXII, 6, pp. 747-758.
Dubost, Ch., Cachera, J. P., Management of long-term survivance after cardiac allografts in humans, in ‟Laval médical", 1970, XLI, pp. 571-576.
Dubost, CH., Cachera, J. P., Blondeau, Ph., Allaines, Cl. d', Les communications interauriculaires de type ostium secundum. 330 opérés à coeur ouvert, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1964, III, pp. 424-442.
Dubost, Ch., Carpentier, A., Aortic heterografts, in ‟Annals of surgery", 1970, CLXXII, suppl. 1, pp. 1-24.
Dubost, Ch., Carpentier, A., Chirurgie du coeur ouvert, in Actualités de chirurgie cardiovasculaire de l'Hôpital Broussais, n. 2 (a cura di Ch. Dubost e A. Carpentier), Paris 1980.
Dubost, Ch., Carpentier, A., Techniques de chirurgie vasculaire, in Actualités de chirurgie cardiovasculaire de l'Hôpital Broussais, n. 3 (a cura di Ch. Dubost e A. Carpentier), Paris 1984.
Dubost, Ch., Carpentier, A., Deloche, A., Lessana, A., Allaines, Cl. d', Blondeau, Ph., Piwnica, A., Cachera, J. P., Soyer, R., Surgery for coronary artery disease, in ‟Journal of cardiovascular surgery", 1971, XII, 3, pp. 243-247.
Dubost, Ch., Carpentier, A., Piwnica, A., Allaines, Cl. d', Blondeau, Ph., Soyer, R., Eisenmann, B., À propos d'une série chirurgicale de 128 insuffisances mitrales par rupture de cordages, in ‟Archives des maladies du coeur et des vaisseaux", 1975, LXVIII, 1, pp. 29-34.
Dubost, Ch., Carpentier, A., Prigent, Cl., Baculard, P., Endocardite fibreuse du ventricule gauche chez un filarien. Possibilités chirurgicales, in ‟Archives des maladies du coeur et des vaisseaux", 1973, LXVI, pp. 1101-1116.
Dubost, Ch., Chauvaud, S., Surgical treatment of complex congenital malformations by non valved atrial diversion, in ‟King Abdulaziz medical journal", 1983, III, 1, pp. 9-28.
Dubost, Ch., Chauvaud, S., Blondeau, Ph., Piwnica, A., Carpentier, A., Traitement chirurgical des discodances atrio-ventriculaires. Expérience de l'Hôpital Broussais, in ‟L'information cardiologique", 1980, n. speciale.
Dubost, Ch., Chauvaud, S., Blondeau, Ph., Piwnica, A., Carpentier, A., Discordances atrio-ventriculaires. Résultats d'une série de 34 opérés, in ‟Archives des maladies du coeur et des vaisseaux", 1975, LXVIII, pp. 813-822.
Dubost, Ch., Guilmet, D., Blondeau, Ph., Piwnica, A., La coarctation de l'adulte âgé. Étude comparative de 20 cas par rapport à un groupe de 190 coarctations de tous âges opérés durant la même période, in ‟Archives des maladies du coeur et des vaisseaux", 1968, LXI, pp. 1252-1268.
Dubost, Ch., Guilmet, D., Parades, B. de, Nouvelle technique d'ouverture de l'oreillette gauche en chirurgie à coeur ouvert: l'abord transseptal bi-auriculaire, in ‟Presse médicale", 1966, LXXIV, pp. 1607-1608.
Dubost, Ch., Guilmet, D., Soyer, R., La chirurgie des anévrysmes de l'aorte, Paris 1970.
Dubost, Ch., Heim de Balsac, M., Anévrysme de l'aorte ascendante. Exérèse. Guérison, in ‟Mémoires de l'Académie de Chirurgie", 1951, LXXVII, pp. 858-863.
Dubost, Ch., Lenfant, C., Passelecq, J., Guery, J., Blondeau, Ph., Weiss, M., Rouanet, J., Heim de Balsac, R., La place de l'arrêt cardiaque provoqué dans la chirurgie à coeur ouvert sous circulation extra-corporelle, in ‟Mémoires de l'Académie de Chirurgie", 1957, XIV, pp. 454-463.
Dubost, Ch., Lenfant, C., Weiss, M., ROuanet, J., Élargissement des limites du système pompe-oxygénateur de Lillehei-De Wall, pour chirurgie cardiaque exsangue, in ‟Presse médicale", 1956, LXIV, pp. 1162-1164.
Dubost, Ch., Lenfant, C., Weiss, M., Rouanet, J., De Wall, R., Nahas, G., Premiers résultats expérimentaux en France de chirurgie cardiaque exsangue avec le systéme pompe-oxygénateur de Lillehei-De Wall, in ‟Presse médicale", 1956, LXIV, pp. 869-872.
Dubost, Ch., Maurice, P., Gerbaux, A., Bertrand, E., Rulliere, R., Vial, F., Barillon, A., Prigent, Cl., Carpentier, A., Soyer, R., The surgical treatment of constrictive fibrous endocarditis, in ‟Annals of surgery", 1976, CLXXXIV, 3, pp. 303-307.
Dubost, Ch., Nahas, G., Lenfant, C., Guery, J., Passelecq, J., Heim de Balsac, R., Weiss, M., Rouanet, J., Fermeture d'une communication inter-ventriculaire à coeur ouvert sous circulation extracorporelle, in ‟Archivs des maladies du coeur et des vaisseaux", 1956, XLIX, pp. 671-677.
Dubost, Ch., Nottin, R., Les anévrysmes de l'aorte thoracique, in Actualités de chirurgie cardiovasculaire de l'Hôpital Broussais, n. 1 (a cura di Ch. Dubost e A. Carpentier), Paris 1979.
Dubost, Ch., Nottin, R., Blondeau, Ph., Allaines, Cl. d', Carpentier, A., Durand, M., Bouchard, F., Gontard, F., Résultats hémodynamiques lointains après cure radicale de la tétralogie de Fallot, in ‟Archives des maladies du coeur et des vaisseaux", 1980, LXXIII, 4, pp. 397-406.
Dubost, Ch., Oeconomos, N., Nenna, A., Milliez, P., Résultats d'une tentative de greffe rénale, in ‟Bulletins et mémoires de la Societé Médicale des Hôpitaux de Paris", 1951, LXVII, pp. 1372-1382.
Dubost, Ch., Oteifa, G., Blondeau, Ph., Le problème technique de le commissurotomie mitrale. Résultats obtenus par dilatation instrumentale de la sténose, in ‟Mémoires de l'Académie de Chirurgie", 1954, LXXX, pp. 321-329.
Dubost, Ch., Piwnica, A., Allaines, Cl. d', Blondeau, Ph., L'abord des communications interventriculaires par atriotomie droite, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1968, VII, pp. 459-471.
Dubost, Ch., Prigent, Cl., Gerbaux, A., Maurice, P., Passelecq, J., Rulliere, R., Carpentier, A., Deloche, A., Surgical treatment of constrictive fibrous endocarditis, in ‟Journal of thoracic and cardiovascular surgery", 1981, LXXXII, 4, pp. 585-591.
Fabiani, J. N., Perier, P., Chelly, J., Camilleri, J. P., Carpentier, A., Dubost, Ch., Blood versus crystalloÄd cardioplegia. Clinical evaluation, in Textbook of clinical cardioplegia (a cura di R. M. Engelman e S. Levitsky), cap. XX, Mount Kisco, USA, 1982.
Fabiani, J. N., Relland, J., Carpentier, A., Myocardial protection via the coronary sinus in cardiac surgery: comparative evaluation of two techniques, in AA.VV., The coronary sinus, Berlin-New York 1984, pp. 305-311.
Fallot, E. L. A., Contribution à l'anatomie pathologique de la maladie bleu, in ‟Marseille médical", 1888, XXV, pp. 77-93, 133-158, 207-223, 270-286, 341-354, 403-420.
Favaloro, R. G., Bilateral internal mammary artery implants, in ‟Cleveland clinic quarterly", 1967, XXXIV, pp. 61-66.
Favaloro, R. G., Saphenous vein autograft replacement of severe segmental coronary occlusion, in ‟Annals of thoracic surgery", 1968, V, pp. 334-339.
Fontan, F., Tricuspid atresia, in Operative surgery, London-Boston 1977, pp. 1152-1157.
Fontan, F., Chauve, A., Deville, Cl., Atrésie tricuspidienne, in ‟Revue du praticien", 1980, XXX, 21, pp. 1341-1354.
Fontan, F., Choussat, A., Tratamiento quirúrgico de la atresía tricúspide, in ‟Hospital General", 1975, XV, pp. 407-416.
Fontan, F., Choussat, A., Brom, A. G., Chauve, A., Deville, Cl., Castro-Cels, A., Repair of tricuspid atresia. Surgical considerations and results, in ‟Pediatric cardiology", 1977, LXIV, pp. 559-566.
Fontan, F., Mounicot, F. B., Baudet, E., Simmoneau, J., Gordo, J., Gouffrant, J. M., Correction de l'atrésie tricuspidienne: rapport de deux cas corrigés par l'utilisation d'une technique chirurgicale nouvelle, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1971, X, pp. 39-47.
Galetti, M., Brecher, G. A., Heart-lung bypass, principles and techniques of extracorporeal circulation, New York 1962.
Gammelgard, R. A., Husfelt, E., Therkelsen, F., Experimental open-heart surgery using a heart-lung machine with a simple disposable oxygenator, in ‟Acta chirurgica scandinavica", 1957, CXII, pp. 439-442.
Gibson, J. H. Jr., Application of a mechanical heart and lung apparatus to cardiac surgery, in ‟Minnesota medicine", 1954, XXXXVII, pp. 171-185.
Glenn, W. W. L., Patino, J. F., Circulatory by-pass of the right heart, in ‟Yale journal of biology and medicine", 1954, XXVII, pp. 147-151.
Grondin, P., eere, C., Limet, R. e altri, Carpentier's annulus and De Vega's annuloplasty: the end of the tricuspid challenge, in ‟Journal of thoracic and cardiovascular surgery", 1975, LXX, pp. 852-861.
Gross, R. E., Hubbard, J. P., Surgical ligation of a patent ductus arteriosus: report of first successful case, in ‟Journal of the American Medical Association", 1939, CXII, pp. 729-731.
Grüntzig, A., Transluminal dilatation of coronary artery stenoses, in ‟Lancet", 1978, I, p. 263.
Guermonprez, J. L., Charron, P., Petitprez, P., Lancelin, B., Camilleri, J. P., Un cas d'angioplastie coronaire, in ‟Actualités en cardiologie", 1979, n. 39, pp. 17-21.
Guiraudon, G., Fontaine, G., Frank, R., Escande, G., Etievnt, P., Cabrol, C., Encircling endocardial ventriculotomy: a new surgical treatment for life-threatening ventricular tachycardias resistant to medical treatment following myocardial infarction, in ‟Annals of thoracic surgery", 1978, XXVI, pp. 438-444.
Hammermeister, K. E., De Roven, T. A., Dodge, H. T., Evidence from a non randomized study that coronary surgeryprolongs survival in patients with two vessel coronary disease, in ‟Circulation", 1979, LIX, pp. 430-435.
Hammermeister, K. E., De Roven, T. A., Dodge, H. T., Variable predictive of survival in patients with coronary disease, in ‟Circulation", 1979, LIX, pp. 421-430.
Hanania, G., Sellier, Ph., Deloche, A., Forman, J., Lelguen, Cl., Fernandez, F., Subat, L., Dubost, Ch., Maurice, P., Gerbaux, A., Résultats à moyen terme de l'onnuloplastiemitrale reconstitutive de Carpentier, in ‟Archives des maladies du coeur et des vaisseaux", 1973, LXVI, pp. 1297-1309.
Hardy, J. D., The first heart transplantin man, in ‟Laval médical", 1970, XLI, pp. 113-118.
Harris, P. J., Lee, K. I., Harrell, F. E., Outcome in medically treated coronary artery disease. Ischemic events: non fatal infarction and death, in ‟Circulation", 1980, LXII, pp. 718-726.
Hume, D. M., Merrill, J. P., Miller, B. F., Thorn, G.L., Experiences with renal homotransplantation in the human, in ‟Journal of clinical investigation", 1955, XXXIV, pp. 327-382.
Hurst, J. W., King, S. B., Logue, R. B. e altri, Value of coronary bypass surgery, in ‟American journal of cardiology", 1978, XLII, pp. 308-329.
Jamieson, S. W., Burton, N. A., Bieber, C. P. e altri, Cardiac allograft survival in primates treated with Cyclosporin, A., in ‟Lancet", 1979, I, p. 545.
Jamieson, S. W. e altri, Cardiac transplantation at Stanford, in ‟Heart transplantation", 1981, I, pp. 86-91.
Jatene, A. D., Fontes, V. F., Paulista, P. P., Successful anatomic correction of transposition of the great vessels, in ‟Arquivos brasileiros de cardiologia", 1975, XXVIII, pp. 461-464.
Jones, E. L., Douglas, K. S., Craver, J. M., Results of coronary revascularization in patients with recent myocardial infarction, in ‟Journal of thoracic and cardiovascular surgery", 1978, LXXVI, pp. 545-551.
Judgutt, B., Fraser, R., Lee, S., Rossal, R., Callaghan, J., Longterm survival after tricuspid valve replacement. Results with seven different prostheses, in ‟Journal of thoracic and cardiovascular surgery", 1977, LXXIV, pp. 20-27.
Kannel, W. B., Feinleib, M., Natural history of angina pectoris in the Framingham study, in ‟American journal of cardiology", 1972, XXIX, pp. 154-163.
Kantrowitz, A., Tjonneland, S., Freed, P. S. e altri, Initial clinical experience with intra-aortic balloon pumping, in ‟Journal of the American Medical Association", 1968, CCIII, pp. 113-118.
Kay, J. H., Egerton, W. S., The repair of mitral insufficiency associated with ruptured chordae, in ‟Annals of surgery", 1963, CLVII, pp. 351-360.
Kay, J. H., Maselli, C., Tsuhi, H., Surgical treatment of tricuspid insufficiency, in ‟Annals of surgery", 1965, CLXII, pp. 53-58.
Kennedy, J. W., Kaiser, G. C., Fisher, L. D., Clinical and angiographic predictors of operative mortality from the collaborative study in coronary artery surgery, in ‟Circulation", 1981, LXIII, pp. 793-802.
Kunlin, J., Les étapes de la chirurgie vasculaire, in Actualités de chirurgie cardiovasculaire de l'Hôpital Broussais, n. 3 (a cura di Ch. Dubost e A. Carpentier), Paris 1984.
Lacorte, M. A., Mac Donald, D., Scheer, C. G., Fyler, D. C., Left ventricular function in tricuspid atresia: angiographic analysis in 28 patients, in ‟Circulation", 1975, LII, pp. 996-999.
Lapeyre, D., Carpentier, A., New concept of a total cardiac prosthesis, in ‟Proceedings of the European Society for Artificial Organs", 1979, VI, pp. 1-7.
Lautier, A., Rey, P., Bizot, J., Faure, A., Sausse, A., Laurent, D., Comparison of gaseous transfer through synthetic membranes for oxygenators, in ‟Transactions. American Society for Artificial Internal Organs", 1969, XV, pp. 144-150.
Lecompte, Y., Neveux, J. Y., Leca, F. e altri, Reconstruction of the pulmonary outflow tract without prosthetic conduit, in ‟Journal of thoracic and cardiovascular surgery", 1982, LXXXIV, 5, pp. 727-733.
Lillehei, C. W. e altri, Vision intracardiac. Surgical correction of the tetralogy of Fallot, in ‟Annals of surgery", 1955, CXLII, pp. 418-445.
Loeffler, W., Endocarditis parietalis fibroplastica mit Blut Eosinophilia, in ‟Schweizerische medizinische Wochenschrift", 1936, LXVI, pp. 817-820.
Merendino, K. A., Thomas, G. I. e altri, The open correction of rheumatic mitral regurgitation, treated by posteromedial annuloplasty using a pump-oxygenator, in ‟Annals of surgery", 1959, CL, pp. 5-22.
Moulopoulos, S. D., Topaz, S., Kolff, W. T., Diastolic balloon pumping in the aorta, in ‟American heart journal", 1962, LXIII, pp. 669-675.
Mustard, W. T., Successful two-stage correction of transposition of the great vessels, in ‟Surgery", 1964, LV, pp. 469-472.
Nicolas, F., Bruniaux, J., Planche, Cl., Binet, J. P., Recent techniques of cardiopulmonary by-pass in infancy (weight below 8 kg). Thirty years of extra-corporeal circulation 1953-1983, in 10th anniversary symposium, April 5-7, 1984, Deutsches Hertzzentrum, München 1985, pp. 75-86.
Norris, R. M., Agnew, T. M., Brandt, P. W. T., Barrat-Boyes, B. J., Coronary surgery after recurrent myocardial infarction: progress of a trial comparing surgical with non surgical management for asymptomatic patients with advanced coronary disease, in ‟Circulation", 1981, LXIII, pp. 785-793.
Nunley, D.L., Grunkeneier, G. L., Teply, J. F., Starr, A., Coronary bypass operation following acute complicated myocardial infarction, in ‟Journal of thoracic and cardiovascular surgery", 1983, LXXXV, pp. 485-491.
Organisation Mondiale de la Santé, Annuaire de statistiques sanitaires mondiales, vol. I, Genève 1973-1976.
Piwnica, A., Nottin, R., Bercot, M., Deloche, A., Allaines, Cl. d', Carpentier, A., Bloneau, Ph., Dubost, Ch., Résultat du traitement chirurgical de 31 cas de perforation septale opérés au cours des 21 prewmiers jours de l'infarctus du myocarde, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1976, XV, 4, pp. 257-262.
Potts, W. S., Smith, S., Gibson, S., Anastomosis of the aorta to the pulmonary artery, in ‟Journal of the American Medical Association", 1946, CXXXII, pp. 627-631.
Rashkind, W., Miller, W. W., Transposition of the great arteries. 8 results of palliation by balloon atrioseptostomy, in ‟Circulation", 1968, XXXVIII, pp. 453-462.
Rastelli, G. C., Wallace, R. B., Ongley, P. A., Complete repair of transposition of the great arteries with pulmonary stenosis, in ‟Circulation", 1969, XXXIX, pp. 83-95.
Read, R. C., Murphy, M. L., Hultgen, H. N., Takaro, T., Survival of men treated for clinic stable angina pectoris. A cooperative randomized study, in ‟Journal of thoracic and cardiovascular surgery", 1978, LXXV, pp. 1-16.
Rentrop, P., Blanke, H., Karsen, K. R. e altri, Selective intra coronary thrombolysis in acute myocardial infarction, in ‟Circulation", 1981, LXIII, pp. 307-317.
Riberolles, C. de, Piwnica, A., Soyer, R., Carpentier, A., Deloche, A., Diamant-Berger, F., Haas, Cl., Dubost, Ch., Problèmes de réanimation et de biotechnologie, in Proceedings du 2ème symposium de chirurgie cardiaque, Paris 19-20 septembre 1975, Paris 1975.
Richard, J. L., Peculiarities of coronary heart disease in the French population, in Atherosclerosis, vol. VI, Berlin-New York 1983, pp. 821-825.
Roberts, A. J., Perioperative myocardial infarction and changes in left ventricular performance, related to coronary artery by-pass graft surgery, in ‟Annals of thoracic surgery", 1983, XXXV, pp. 208-225.
Ross, D., Homotransplantation of the aortic valve in the sub-coronary position, in ‟Journal of thoracic and cardiovascular surgery", 1964, XLVII, pp. 713-719.
Sanfelipo, P. P., Giuliani, S., Danielson, G., Wallace, R., Pluth, J., Mc Goon, D. C., Tricuspid valve prosthetic replacement, in ‟Journal of thoracic and cardiovascular surgery", 1976, LXXI, pp. 441-445.
Schechter, D. Ch., Electrical cardiac stimulation, Minneapolis 1983.
Senning, A., Surgical correction of transposition of the great vessels, in ‟Surgery", 1959, XLV, pp. 966-980.
Shumway, N. E. e altri, Heart and heart and lung transplantation at Stanford University: 1968-1981, in Proceedings of the Beijing symposium of cardiothoracic surgery (a cura di L. A. Brewer III), Beijing, China, 1981.
Sims, F. H., A comparison of coronary and internal mammary arteries and implications of the results in the etilogy of arteriosclerosis, in ‟American heart journal", 1983, CVI, pp. 560-566.
Soots, G., Warembourg, H., Stankowiak, C. e altri, Place de la plexectomie dans le traitement de l'angor de Printzmetal, in ‟Annales de chirurgie", 1982, XXXVI, pp. 611-613.
Soyer, R., Allaines, Cl. d', Blondeau, Ph., Piwnica, A., Carpentier, A., Dubost, Ch., Insuffisance aortique associée à une communication interventriculaire. À propos de 34 cas opérés, in ‟Annales de chirurgie thoracique et cardiovasculaire", 1975, XIV, 2, pp. 99-104.
Starr, A., Edwards, M. L., Mitral replacement: the shielded ball valve prosthesis, in ‟Journal of thoracic and cardiovascular surgery", 1961, XLII, pp. 673-682.
Starr, A., Grunkemeier, G., Lambert, L., Mitral valve replacement, in ‟Circulation", 1976, LIV, suppl. 3, pp. 47-56.
Starzl, Th. E., Marchioro, T. L., Kaulla, K. N. von, Homotranspantation of the liver in humans, in ‟Surgery, gynecology and obstetrics", 1963, CXVII, pp. 659-676.
Suma, K., Tsuji, T., Clinical performance of microporous polypropylene hollow-fiber oxygenator, in ‟Annals of thoracic surgery", 1981, XXXII, pp. 558-562.
Takado, T., Hultgen, H. N., Lipton, M. J., The V.A. cooperative randomized study of surgery for coronary arterial occlusive disease. II. Subgroup with significant left main lesions, in ‟Circulation", 1976, LIV, suppl. 3, pp. 107-117.
Thurer, R. L., Lytle, B. W., Cosgrove, B. M., Loop, F. D., Asymptomatic coronary artery disease managed by myocardial revascularization: results at 5 years, in ‟Circulation", 1979, LX, pp. 1-14.
Varnauskas, E., Olsson, S. B., Carlstom, E., Peterson, L. E., Prospective randomized study of coronary bypass surgery in stable angina pectoris: second interim report by European coronary artery surgery group, in ‟Lancet", 1980, II, pp. 491-501.
Vlietsra, R. E., Assad-Morell, J. L., Frye, R.L. e altri, Survival predicators in coronary artery disease. Medical and surgical comparisons, in ‟Mayo clinic proceedings", 1977, LII, pp. 85-90.
Waterston, D. J., Treatment of Fallot's tetralogy in children under 1 year of age, in ‟Rozhledy v chirurgii", 1962, XLI, pp. 181-183.
Wooler, G. H., Nixon, P. G. F., Grimshaw, V. A., Watson, D. A., Experiences with the repair of the mitral valve in mitral incompetence, in ‟Thorax", 1962, XVII, pp. 49-57.
Neurochirurgia di Gian Franco Rossi
SOMMARIO: 1. Introduzione. □ 2. Cenni storici. □ 3. Situazione attuale. □ 4. I mezzi della diagnostica: a) esame clinico; b) radiologia; c) medicina nucleare; d) elettrofisiologia; e) registrazione della pressione intracranica; f) ecografia; g) risonanza magnetica nucleare; h) biopsia. □ 5. Le modalità del trattamento: a) finalità; b) mezzi; c) tipo di approccio. □ 6. I campi di applicazione: a) malformazioni non vascolari; b) malformazioni vascolari; c) traumi; d) tumori; e) infezioni e parassitosi; f) idrocefalo e alterazioni della circolazione liquorale; g) alterazioni vascolari acquisite; h) alterazioni degenerative del rachide; i) epilessie parziali; l) dolori cronici; m) distonie e discinesie. □ Bibliografia.
1. Introduzione.
La neurochirurgia è quella branca delle scienze biomediche che si occupa di alterazioni anatomo-funzionali o malattie del sistema nervoso trattabili con metodologie chirurgiche.
Il sistema nervoso può essere interessato primitivamente, cioè da una malattia che origina nel sistema nervoso stesso (per esempio un tumore cerebrale), o secondariamente, cioè da un processo morboso che origina in altri sistemi o organi e che coinvolge le strutture nervose in un secondo tempo (per esempio un tumore del cranio che, accrescendosi, comprime il cervello). Tutte le diverse componenti del sistema nervoso sono considerate, ai livelli endocranico, endorachideo e periferico (v. tab. I). Oltre alle malattie del sistema nervoso, la neurochirurgia considera anche patologie di altri sistemi o organi che abbiano con il sistema nervoso rapporti anatomici e funzionali molto stretti (come ad esempio l'ipofisi). Le alterazioni del sistema nervoso di competenza neurochirurgica possono insorgere a qualunque età e avere natura diversa; le principali, tuttavia, sono quelle di natura malformativa, traumatica, neoplastica o tumorale, circolatoria e infettiva.
È evidente che per assolvere i suoi compiti terapeutici la neurochirurgia presuppone: 1) la dettagliata conoscenza di base dell'organizzazione strutturale (neuroanatomia) e funzionale (neurofisiologia e neurochimica) del sistema nervoso; 2) la conoscenza della genesi delle alterazioni anatomiche e funzionali (eziologia) e la conoscenza dei meccanismi attraverso i quali gli agenti causali esplicano i loro effetti patogeni (patogenesi); 3) la conoscenza e la disponibilità dei mezzi atti a rivelare gli aspetti strutturali e funzionali del sistema nervoso in condizioni di normalità e malattia (diagnostica); 4) la conoscenza e la disponibilità dei mezzi appropriati per sopprimere o per correggere chirurgicamente le alterazioni anatomo-funzionali riscontrate (terapia). D'altra parte, la neurochirurgia è fonte preziosa di informazioni per il continuo progredire della conoscenza dell'organizzazione anatomo-funzionale del cervello umano. Per quanto sopra, e tenendo presente l'estrema delicatezza, complessità e importanza degli organi su cui opera - dalla corteccia cerebrale al più periferico dei nervi -, la neurochirurgia è una delle branche medicochirurgiche più complesse, che richiede una preparazione lunga e altamente specializzata e strutture organizzative di alto livello.
2. Cenni storici.
Le più antiche manipolazioni intenzionali del cranio, consistenti in aperture (o craniectomie) di varia forma e dimensione, risalgono al Paleolitico. Risalgono invece al Neolitico i più antichi strumenti, verosimilmente usati a tale scopo, che ci sono pervenuti: si tratta di strumenti in pietra, semplici ma efficaci. Non ci è dato sapere con certezza se queste ‛operazioni' sul cranio avessero scopi terapeutici o di altra natura, per esempio rituali; sappiamo che questi interventi erano eseguiti in pazienti viventi, che poi sopravvissero a lungo, come dimostrato da una ben evidente rigenerazione ossea. In alcuni casi la vicinanza di linee di frattura all'apertura del cranio praticata dal ‛chirurgo' fa pensare a finalità terapeutiche. Notizie scritte sulla possibilità di affrontare chirurgicamente malattie del sistema nervoso ci giungono dall'antico Egitto, e risalgono all'incirca al secondo millennio avanti Cristo; l'enciclopedico Ippocrate fa menzione di alcune indicazioni alla trapanazione cranica. Tuttavia dobbiamo risalire fino verso la fine del dodicesimo secolo per trovare documentazioni attendibili e dettagliate di interventi definibili come ‛neurochirurgici', con osservazioni accurate delle menomazioni funzionali conseguenti alla mutilazione delle diverse parti del sistema nervoso a opera della malattia o del chirurgo. Questi documenti sono particolarmente abbondanti in Italia, Francia e Spagna, e si moltiplicano nei secoli successivi, integrati da descrizioni dell'intervento e da illustrazioni di strumenti progettati ad hoc . Le notizie relative a operazioni neurochirurgiche, tuttavia, hanno carattere occasionale e si trovano mescolate con quelle, ben più numerose, relative a interventi chirurgici su altri organi. E solamente sul finire del XIX secolo che la chirurgia diretta a sopprimere o ad alleviare danni del sistema nervoso comincia a delinearsi come una branca particolare della chirurgia, anche se ancora legata alla chirurgia generale. Cominciano a comparire le prime opere dedicate esclusivamente alla neurochirurgia, che tentano una sistematizzazione della materia e ne delineano le basi scientifiche; tra queste opere, ben note in Italia, ricordiamo La nuova chirurgia del sistema nervoso centrale di A. D'Antona (1893-1894) e Chirurgia craniocerebrale di V. Padula (1895). Sempre in quest'epoca lo sviluppo della chirurgia del sistema nervoso è notevolmente favorito sia dal parallelo progredire della conoscenza dell'anatomia e della fisiologia, sia dallo svilupparsi dell'anestesia e dell'asepsi. Agli inizi del nostro secolo gli interventi neurochirurgici diventano sempre più complessi e vengono praticati nei maggiori centri chirurgici di tutto il mondo. La loro esecuzione, però, è ancora affidata a chirurghi generali, ai quali, pur nel rispetto del parere dei neurologi, viene lasciato il compito della diagnosi o, più in generale, della valutazione dell'alterazione neurologica da trattare. Gradatamente comincia prima a delinearsi, quindi a realizzarsi, quella integrazione, culturale e pratica, sperimentale e clinica, tra scienze neurologiche e scienze chirurgiche che porterà alla definitiva configurazione della neurochirurgia e del neurochirurgo. Si costruiscono le prime strutture assistenziali dedicate esclusivamente alla neurochirurgia, e i neurochirurghi, forti della loro nuova e ora completa preparazione, diventano indipendenti da altri specialisti, anche se, ovviamente, continuano a collaborare con essi (v. Walker, 1951; v. Horrax, 1952; v. Sachs, 1952; v. Wertheimer e David, 1979).
L'importantissimo contributo alla conoscenza delle strutture e del modo di funzionare del cervello dell'uomo fornito dalla neurochirurgia consente un enorme progresso nell'affrontare i problemi sia diagnostici sia terapeutici propri della nuova disciplina. In Italia, nonostante le lontane radici storiche sopra indicate, e nonostante la valida attività neurochirurgica svolta in diversi ospedali, la neurochirurgia ha dovuto attendere un tempo relativamente lungo (fino agli anni cinquanta) prima di potersi staccare dalla chirurgia generale ed essere ufficialmente riconosciuta come una branca a sé stante delle scienze medicochirurgiche (v. Rossi, 1981; v. Guidetti e altri, 1983).
3. Situazione attuale.
Attualmente la neurochirurgia è praticata in strutture autonome, nell'ambito di organizzazioni ospedaliere o universitarie, da chirurghi specialisti. La qualifica di ‛specialista in neurochirurgia', riconosciuta dallo Stato, si consegue in scuole ufficialmente autorizzate, universitarie, cui si accede per concorso dopo il conseguimento della laurea in medicina e chirurgia. In considerazione della grande responsabilità di cui è investito il medico che viene qualificato come neurochirurgo e della facilità attuale di trasferimento da un paese all'altro, di recente si è fatta rilevare, da parte di organizzazioni mediche, di università, di organi governativi di diversi paesi, l'opportunità di controlli sulla completezza e sulla qualità di formazione del giovane che si dedica alla neurochirurgia. Ciò ha portato ad alcuni provvedimenti concreti: ad esempio, nell'ambito della Comunità Economica Europea (CEE), che comprende la maggior parte dei paesi europei occidentali, è da poco divenuto operante e vincolante uno schema di formazione e preparazione professionale comune a tutti i paesi membri (v. tab. II).
L'accrescersi delle conoscenze nell'ambito dell'anatomia, della fisiologia e della patologia del sistema nervoso, lo sviluppo rapido e continuo della tecnologia e quindi di metodologie e mezzi per la ricerca, per la diagnostica e per la tecnica operatoria, il conseguente espandersi delle possibilità terapeutiche hanno fatto si che sia assai difficile oggi, per un solo individuo, raggiungere quel livello di cultura e di esperienza neurochirurgiche necessario per affrontare validamente tutti i campi di applicazione pratica e contribuire contemporaneamente al progredire del sapere. Per queste ragioni si è andata delineando negli ultimi anni la tendenza di non pochi neurochirurghi a dedicarsi o a occuparsi prevalentemente di settori particolari della disciplina. Questi settori vengono abitualmente definiti come ‛subspecialità'. I più affermati tra essi sono: neurochirurgia infantile, neurotraumatologia, neurochirurgia funzionale e stereotassica.
La neurochirurgia infantile si occupa dello studio, diagnosi e trattamento della patologia del sistema nervoso, di interesse chirurgico, dall'età neonatale fino all'incirca ai 12-15 anni. Molti aspetti di questa patologia sono peculiari dell'infanzia o hanno nell'infanzia rilevanza particolare: ricordiamo, per esempio, quelli relativi a malformazioni cranio-encefaliche e vertebro-midollari (v. cap. 6, § a; v. tavv. II, 1 e III, 1), a disordini - spesso congeniti - della circolazione liquorale con conseguente idrocefalia (v. cap. 6, § f), a certe forme tumorali (v. cap. 6, § d). Inoltre, indipendentemente dalle caratteristiche della patologia da studiare e trattare, il bambino - in quanto tale - richiede modalità assistenziali del tutto particolari (v. Matson, 1969; v. Milhorat, 1978).
La neurotraumatologia si occupa dei problemi dell'impostazione diagnostica e del trattamento dei traumi del cranio-encefalo, rachide-midollo e nervi periferici. Diversi fattori contribuiscono a dare una particolare connotazione a questa subspecialità: innanzitutto, alcuni aspetti anatomoclinici della patologia traumatica, con le conseguenti particolari implicazioni per quanto attiene alle modalità del trattamento chirurgico; in secondo luogo, la necessità di un'organizzazione capace di accogliere il paziente e di entrare in azione in tempi brevissimi, pena l'inutilità dell'intervento per l'impossibilità di correggere il danno del trauma o addirittura di impedire la morte del paziente (v. cap. 6, È c); in terzo luogo, l'opportunità di organizzare un tipo di assistenza postchirurgica, di solito in collaborazione con i centri di rianimazione e di riabilitazione, adeguata al trattamento, per tempi anche lunghi, di pazienti in condizioni molto gravi (si pensi a certi stati di coma posttraumatico che persistono per mesi; v. Visalli, 1972; v. Vinken e Bruyn, 1975; v. Popp, 1979).
La neurochirurgia funzionale e stereotassica, infine, si caratterizza per la peculiarità dei suoi obiettivi chirurgici e per la metodologia cosiddetta stereotassica, della quale spesso si avvale. L'obiettivo di questa subspecialità è quello di riuscire a trattare certe alterazioni funzionali del sistema nervoso correggendole o bilanciandole opportunamente, pur senza rimuovere la causa della malattia. Ad esempio, è possibile cercare di sopprimere o alleviare il dolore cronico da cancro di un qualsiasi distretto corporeo, non rimuovendo la causa prima del dolore, cioè il cancro - perché in stadio divenuto inoperabile -, ma agendo sulle vie nervose che trasmettono la sensibilità dolorifica del distretto corporeo colpito (v. figg. 35 e 37); i mezzi utilizzati a tale scopo sono vari e vanno dall'interruzione anatomica di dette vie al blocco della conduzione degli impulsi dolorifici con stimolazione elettrica o chimica locale. Oltre al dolore, i campi d'azione più importanti della neurochirurgia funzionale sono le distonie o discinesie (ad es. il morbo di Parkinson e la spasticità) e le epilessie resistenti alla terapia con farmaci. Altro suo campo d'azione è quello di alcune malattie psichiatriche (la cosiddetta psicochirurgia); questo settore della neurochirurgia funzionale, tuttavia, attualmente è di importanza pratica assai limitata e in alcuni paesi - come l'Italia - praticamente abbandonato.
La metodologia stereotassica è peculiare di questa subspecialità, che utilizza, peraltro, anche altri mezzi chirurgici comuni a tutta la neurochirurgia. Questa metodologia (che verrà descritta più avanti in dettaglio: v. cap. 5) fa uso di uno speciale apparecchio - detto appunto stereotassico (v. tav. IV, 1) - che consente di introdurre con la massima precisione in qualsiasi punto dello spazio endocranico - e quindi in qualsiasi struttura del cervello - piccoli strumenti, come elettrodi o cannule, attraverso forellini di trapanazione (circa 2-3 mm): mediante tali strumenti diviene possibile effettuare importanti manovre diagnostiche, quali la registrazione dell'attività elettrica locale o il prelievo bioptico di tessuto, e terapeutiche, quali la distruzione o la stimolazione elettrica circoscritta di strutture nervose prescelte o l'infissione di isotopi radioattivi in tumori.
Queste subspecialità, con l'unica eccezione della neurochirurgia infantile, che può attuarsi nell'ambito di ospedali esclusivamente pediatrici, devono necessariamente integrarsi reciprocamente tra di loro e con la neurochirurgia generale in un unico complesso armonico.
4. I mezzi della diagnostica.
La diagnostica neurochirurgica e neurologica ha progredito in modo assai rilevante in anni recenti, soprattutto nell'ultimo decennio. Questo progresso, in gran parte dovuto alla straordinaria evoluzione della tecnologia, e in particolare alla scienza dei calcolatori, ha reso disponibili tecniche che possono dare informazioni diagnostiche molto più rapidamente, più accuratamente e con minor rischio per il paziente di quanto non fosse possibile in precedenza. Una sintesi dei possibili mezzi diagnostici di cui oggi la neurochirurgia si avvale - mezzi classici e mezzi ancora in via di sviluppo - è proposta nella tab. III. Nel presente capitolo non si entrerà nei dettagli delle diverse metodologie diagnostiche considerate, ma si cercherà di illustrarne gli aspetti più importanti ai fini della loro utilizzazione in neurochirurgia, specie per quanto riguarda le metodologie più recenti. Esemplificazioni sull'applicazione dei mezzi diagnostici riportati si troveranno nei capitoli successivi. Inoltre, non verranno qui considerati altri procedimenti diagnostici cui il paziente neurochirurgico viene abitualmente sottoposto, in quanto o comuni a tutte le branche della medicina e chirurgia (per esempio tutti gli esami di chimica clinica), o facenti parte di altre specialità ben definite, come, ad esempio, la neuro-oftalmologia e la neuro-otologia. Per un'informazione esauriente sulla diagnostica si rimanda alla trattatistica neurologica (v. Macchi, 1981; v. Bergamini, 1983; v. Fazio e Loeb, 1984) e neurochirurgica (v. David e altri, 1961; v. Mullan, 1961; v. Davis e Davis, 1963; v. Matson, 1969; v. Jennett, 1970; v. Northfield, 1973; v. Milhorat, 1978; v. Pagni, 1978; v. Youmans, 1982). Sembra opportuno precisare che, nella maggior parte dei casi, alla diagnosi finale si perviene non con un solo esame, ma attraverso l'integrazione di esami diversi. Nella pratica clinica il ricorso ai vari mezzi diagnostici disponibili segue una certa logica, dettata da un lato dal particolare tipo di informazione che ogni esame può dare, dall'altro dall'ovvia opportunità di dare la precedenza agli esami meno traumatizzanti per il paziente; da quest'ultimo punto di vista, si usa suddividere i mezzi diagnostici in due grandi categorie, ‛non invasivi' e ‛invasivi', per invasivo intendendosi quel tipo di esame che impone un certo trauma per il paziente - quale ad esempio l'introduzione di ago o catetere o sonda direttamente nel sistema nervoso o negli spazi liquorali o nelle arterie - e che quindi comporta un certo rischio.
Il primo posto dato nel presente capitolo all'esame clinico del paziente, eseguito al letto in corsia o ambulatorialmente, non è casuale. Nonostante il continuo sviluppo dei mezzi diagnostici strumentali - cui in effetti è dedicata tutta la rimanente parte del capitolo - l'esame clinico tradizionale, completo in tutti i suoi aspetti, anamnesi ed esame obiettivo, conserva un grande valore. Esso è essenziale e insostituibile per una prima impostazione diagnostica del paziente. In una logica progressione dell'iter diagnostico, gli esami strumentali seguono l'esame clinico, sono scelti sulla base delle indicazioni date dall'esame clinico stesso e vanno intesi come esami di conferma e precisazione. Il corpo principale dell'esame clinico in neurochirurgia è costituito dall'esame cosiddetto neurologico, cioè dal rilevamento, l'analisi e la valutazione del modo di insorgere, delle caratteristiche qualitative e dell'entità delle alterazioni delle funzioni basilari del sistema nervoso (quali ad esempio la capacità motoria o la sensibilità). In molti casi l'esame propriamente neurologico deve essere integrato da esami neuropsicologici e psichiatrici, cioè da un'analisi e una valutazione delle funzioni cerebrali cosiddette superiori, e in particolare dei rapporti cervello-comportamento (v. Macchi, 1981; v. Youmans, 1982; v. Bergamini, 1983; v. Howe, 1983; v. Fazio e Loeb, 1984).
b) Radiologia.
Storicamente il primo mezzo diagnostico strumentale utilizzato dalla neurochirurgia, la radiologia applicata allo studio della patologia del sistema nervoso ha oggi acquisito una rilevanza culturale e pratica tale da configurarsi come un settore ben individualizzato della radiologia: la neuroradiologia. In molti grandi centri ospedalieri, universitari e non, la neuroradiologia è strutturata come servizio diagnostico autonomo operante in stretta collaborazione da un lato con la radiologia generale, dall'altro con la neurochirurgia e la neurologia. Il tipo di informazione che la neuroradiologia può dare è essenzialmente morfologico: in particolare, essa può rivelare presenza, forma, dimensione e topografia della patologia cranio-encefalica e vertebro-midollare. Essa può dare anche informazioni utili - ma raramente probanti - per interpretare la natura della patologia stessa (v. Taveras, 1964; v. Ruggiero e altri, 1977; v. Lenzi e Salvolini, 1978; v. Youmans, 1982, vol. I).
Lo studio radiologico diretto è il mezzo non invasivo non solamente più semplice, ma anche più efficace, quando si vada alla ricerca di alterazioni della struttura ossea del cranio e del rachide, o di calcificazioni abnormi al loro intemo; esempi tipici sono le fratture causate da traumi, le deformazioni causate da tumori o da malformazioni o da processi degenerativi, oppure i depositi di calcio all'interno di tumori. Lo studio radiologico eseguito in tomografia consente di visualizzare meglio alcuni dettagli strutturali. L'elaborazione o analisi computerizzata dello studio radiologico eseguito con tagli tomografici assiali, o tomografia assiale computerizzata (TAC), introdotta nel 1973 (v. Hounsfield, 1973; v. Gawler e altri, 1975; v. Lee e Oawler, 1978; v. Spiess, 1982), ha portato a un salto qualitativo dell'indagine radiologica di rilevanza enorme per tutta la diagnostica medicochirurgica, e in particolare neurochirurgica. L'esame, non invasivo, può mettere in evidenza non solamente alterazioni della struttura ossea, ma anche alterazioni del contenuto intracranico e intrarachideo. È così possibile, ad esempio, distinguere la sostanza cerebrale bianca da quella grigia; visualizzare molto bene tutti gli spazi contenenti liquido cefalo-rachidiano, cioè ventricoli, cisterne e spazi subaracnoidei in genere; conseguentemente, mettere in evidenza deformazioni della topografia cerebrale e midollare (per es. da malformazioni o da masse occupanti spazio); riconoscere alterazioni strutturali del parenchima cerebrale (per es. edema) e la presenza di tessuti o formazioni patologiche (per es. tumori o cicatrici o ascessi; v. figg. 4, 16, 22, 24, 25, 26) e di raccolte ematiche abnormi. L'iniezione endovenosa di un mezzo di contrasto - cioè di una sostanza iodata opaca ai raggi X - che può fissarsi nel tessuto nervoso alterato dalla malattia o in tessuti neoformati in rapporto al loro grado di vascolarizzazione, accresce considerevolmente la potenzialità diagnostica della TAC.
Prima dell'avvento della TAC, le metodologie radiologiche più usate dal neurochirurgo erano invasive; esse sono elencate nella tab. III. Un primo gruppo di indagini si basa sulla visualizzazione degli spazi liquorali endocranici (ventricolografia, cisternografia) ed endorachidei (mielografia), nei quali viene introdotto un mezzo di contrasto positivo (cioè radiopaco, di solito una sostanza iodata, preferibilmente idrosolubile) o negativo (cioè radiotrasparente, di solito aria); i mezzi di contrasto possono essere immessi mediante puntura diretta di un ventricolo cerebrale, previa trapanazione cranica (ventricolografia: storicamente l'esame invasivo più antico, concepito da W. Dandy nel 1918 esclusivamente per scopi neurochirurgici); oppure per puntura diretta della cisterna magna (cisternografia); oppure per iniezione nello spazio subaracnoideo a livello lombare, da dove il mezzo iniettato può essere fatto scendere o risalire lungo il rachide, fino all'endocranio e fino a penetrare nei ventricoli cerebrali o nelle cisterne pericerebrali, variando opportunamente la posizione del paziente (mielografia, gassosa o con mezzi radiopachi; pneumoencefalografia; v. Jirout, 1969; v. Shapiro, 1975). Questo gruppo di esami può dare tre tipi principali di informazione, relativi, rispettivamente, alle dimensioni, all'intercomunicabilità e alla morfologia degli spazi liquorali. I primi due tipi di informazione sono molto utili per la diagnosi di alterazioni della circolazione liquorale, quali si possono avere, ad esempio, nelle diverse forme di idrocefalia; il terzo tipo di informazione serve a rilevare processi occupanti spazio a livello sia endocranico (per es. tumori) sia endorachideo (per es. tumori e ernie del disco). Divenuta disponibile la TAC, sopra ricordata, il ricorso a questi mezzi diagnostici è considerevolmente diminuito, in quanto buona parte delle informazioni da essi fornite possono essere ottenute, appunto, con la TAC, senza ricorso a manovre invasive. Essi sono ancora utili, tuttavia, in alcuni casi particolari, specie nella patologia endorachidea (per es. ernie discali, tumori e aracnoiditi). Di recente questi mezzi diagnostici - in particolare la cisternografia e la mielografia con mezzo di contrasto radiopaco - sono stati combinati con la TAC con risultati molto buoni e con la possibilità di risolvere quesiti diagnostici particolarmente ardui, dato che i due mezzi potenziano vicendevolmente le loro peculiari proprietà.
L'angiografia costituisce il secondo tipo di mezzi diagnostici radiologici invasivi. Essa si basa sull'introduzione di un mezzo di contrasto radiopaco per puntura diretta o mediante cateterismo in una arteria alimentante il cervello (arterie carotidi o arterie vertebrali) o il midollo spinale. L'esame fu proposto da Moniz nel 1927. Radiogrammi senati visualizzano dapprima l'albero arterioso, quindi il circolo capillare e infine il circolo venoso. Lo studio angiografico trova le sue indicazioni più importanti nella patologia vascolare malformativa (specie aneurismi, e malformazioni artero-venose) e ostruttiva (stenosi o ostruzioni delle arterie o delle vene da processi degenerativi della parete del vaso, per es. placche ateromatose da trombosi o embolia di varia natura o origine). Esso è inoltre molto utile, a integrazione della TAC, per una più precisa definizione diagnostica in caso di tumori endocranici (v. Pansini e Conti, 1984). Da ricordare, in particolari casi di patologie dei seni venosi endocranici, la venografia epidurale. La tecnica della cosiddetta sottrazione di immagine e, soprattutto, l'applicazione dell'analisi computerizzata e della digitalizzazione (v. Weinstein e altri, 1981) hanno accresciuto la potenzialità diagnostica dell'angiografia e ne hanno ridotto l'invasività. Infatti, con l'angiografia in sottrazione digitalizzata è sufficiente, in certi casi (per es. diagnosi di alterazione delle arterie carotidi e vertebrali nel loro decorso extracranico), iniettare il mezzo di contrasto in vena anziché in arteria e, comunque, la quantità di mezzo di contrasto necessaria è minore che nell'angiografia tradizionale.
c) Medicina nucleare.
Uno dei primi contributi della medicina nucleare alla diagnostica neurochirurgica fu la cosiddetta scintigrafia cerebrale, nata dalle osservazioni di Moore attorno al 1948. Mezzo diagnostico non invasivo, essa si basa sul fatto che sostanze marcate con radioisotopi e iniettate in circolo per via endovenosa, in caso di alterazioni della barriera ematoencefalica (per es. da ischemia o da tumore) o in presenza di vasi patologici neoformati (per es. in certi tumori), si fissano al tessuto e sono rilevabili dall'esterno con captatori di radiazioni. Questa classica metodologia, tuttavia, è oggi largamente sostituita dalla TAC. Attualmente, i vantaggi più rilevanti offerti dalla medicina nucleare sono relativi allo studio del circolo liquorale e del circolo arterioso cerebrale.
La cisternoscintigrafia è un esame invasivo che viene utilizzato quando si vuole studiare la dinamica liquorale a livello endocranico; tramite puntura lombare o cisternale si inietta nello spazio liquorale una sostanza - per esempio sieroalbumina - opportunamente marcata con radioisotopi (come tecnezio 99 o iodio 112), che segue la circolazione liquorale. È quindi facile, con rilevazioni dall'esterno seriate nel tempo, caratterizzare questa circolazione (v. Di Chiro e altri, 1968) e mettere bene in evidenza ostacoli al circolo (certe forme di idrocefalo), ritardi nell'assorbimento e vie vicarianti rispetto a quelle normali dell'assorbimento stesso (per es. nell'idrocefalo normoteso dell'adulto), percorsi anormali del liquor (per es. nelle fistole liquorali).
Lo studio del circolo cerebrale (emodinamica cerebrale) è attuabile con due tipi di esami: l'angioscintigrafia e lo studio del flusso cerebrale. Quest'ultimo è in grado di fornire informazioni più numerose e più precise del primo. Introdotto da Kety nel 1945, ha subito nei decenni successivi importantissime evoluzioni tecnologiche e applicative, e attualmente risulta della massima importanza per il corretto inquadramento diagnostico dei disordini (insufficienza) del circolo cerebrale di varia origine (v. Brock e altri, 1969; v. Russel, 1971; v. Gotoh e altri, 1979). Esso è quindi assai utile al neurochirurgo, in particolare quando si ponga il problema della rivascolarizzazione chirurgica in pazienti con insufficienza circolatoria. La sostanza, marcata con isotopi gammaemittenti (per es. xenon 133), può venire introdotta direttamente nel circolo carotideo (quindi con manovra invasiva) oppure può raggiungere la corrente ematica dopo essere stata malata per via respiratoria (protossido di azoto, xenon), quindi con modalità non invasiva. Essa viene quindi rilevata da scintillatori multipli disposti opportunamente attorno al capo. È così possibile analizzare il flusso ematico in più di 200 regioni cerebrali simultaneamente (il cosiddetto ‛flusso ematico cerebrale regionale', o ‛rCBF'). Oltre che per lo studio delle insufficienze circolatorie, il mezzo ha trovato interessanti applicazioni in epilettologia, in varie forme di coma post-traumatico e nelle demenze.
Benché ancora in via di sviluppo, e quindi accessibile solamente in pochi centri, è opportuno ricordare l'ultimo nato dei mezzi diagnostici della medicina nucleare di interesse neurochirurgico: la tomografia a emissione di positroni (positron emission tomography, PET), un esame proposto da Phelps e collaboratori nel 1976. Metodologia non invasiva, consente di ottenere informazioni qualitative e quantitative su alcuni aspetti del metabolismo e del circolo cerebrale regionale: in particolare, flusso ematico, volume ematico, estrazione frazionata di ossigeno, metabolismo dell'ossigeno (v. tav. I, 2). A tutt'oggi, le applicazioni più interessanti sono quelle nel campo delle malattie cerebrovascolari, in modo particolare le insufficienze circolatorie, e possono dare risultati di considerevole interesse per la pianificazione di interventi neurochirurgici diretti a ristabilire una buona circolazione cerebrale, ad esempio in pazienti con attacchi ischemici transitori o con ictus. Importanti anche le possibilità di studio delle alterazioni metaboliche di zone cerebrali epilettogene e del metabolismo di certi tumori cerebrali. L'integrazione della diagnostica TAC, di natura morfologica, con quella PET, di natura metabolica, sembra offrire oggi interessantissime possibilità (v. Lenzi e altri, 1981; v. Wise e altri, 1983).
d) Elettrofisiologia.
Tutte le cellule del sistema nervoso, a tutti i suoi livelli, centrale e periferico, attraverso rapidissime variazioni di polarizzazione della membrana cellulare generano potenziali di azione che si propagano lungo gli assoni delle cellule stesse: gli impulsi nervosi (v. Moruzzi, 1975). Questi impulsi raggiungono altre cellule nervose o effettori periferici (per esempio i muscoli) e, attraverso la liberazione di neurotrasmettitori (trasmissione sinaptica), ne provocano e ne modulano la funzione (v. neurone e impulso nervoso; v. sinapsi: Fisiologia della sinapsi periferica). Il continuo succedersi della variazione di polarizzazione della membrana cellulare e l'enorme viavai dei potenziali d'azione lungo le fibre nervose producono variazioni di potenziale che possono, se opportunamente amplificate, essere registrate. L'analisi di questi fenomeni bioelettrici (v. elettrofisiologia) può, naturalmente entro certi limiti, dare indicazioni sulle condizioni funzionali del sistema nervoso centrale e periferico e dei muscoli, in situazioni normali (elettrofisiologia o neurofisiologia di base) e in situazioni abnormi o patologiche (elettrofisiologia o neurofisiologia clinica). Le applicazioni diagnostiche dell'elettrofisiologia sono numerose (v. Remond, 1971-1978), e alcuni di questi esami sono di uso assai comune in neurochirurgia (per es. EEG ed EMO); altri più sofisticati, richiedenti attrezzature particolari o manovre invasive molto delicate (per es. la SEEG), sono attuabili solamente in centri particolarmente qualificati e in casi clinici selezionati.
Lo studio dell'attività elettrica cerebrale spontanea (cioè a esclusione di sue variazioni provocate intenzionalmente con stimolazioni) con elettrodi applicati sullo scalpo (elettroencefalografia o EFO) fa oggi parte del gruppo delle indagini preliminari in tutti i casi in cui si sospetti una patologia endocranica, indipendentemente dalla sua natura (v. Kooi, 1971). Tuttavia, in neurochirurgia, questo mezzo diagnostico trova le sue indicazioni principali nelle due seguenti situazioni patologiche: stati di coma ed epilessia.
Nel paziente in coma per grave danno cerebrale - indipendentemente dalla natura del danno, sia esso da trauma, da ipertensione endocranica per tumore o altro, da lesione vascolare emorragica o ischemica - alcuni caratteri dell'attività elettrica cerebrale possono rendere edotti sul livello della lesione causale, sulla profondità del coma e sulla sua evoluzione o prognosi. Di particolare interesse l'utilizzazione dell'EEG, ripetuto nel tempo, per la prognosi degli stati di coma di lunga durata (settimane o mesi; v. Bricolo e altri, 1968). Da ricordare che l'esame EEG è considerato indispensabile dalla legge per la diagnosi di morte cerebrale (rianimazione).
Nel paziente con epilessia lo studio dell'attività elettrocerebrale è essenziale per una corretta comprensione delle caratteristiche del processo epilettico. Ai fini neurochirurgici, tuttavia, l'EEG tradizionale - cioè attuato con elettrodi applicati sullo scalpo - può non essere sufficiente; ad esempio, possono sfuggire scariche epilettiche che nascono da strutture cerebrali profonde, come quelle limbiche, oppure la definizione della topografia o organizzazione spaziale della zona epilettogena non è adeguatamente precisabile. Queste carenze hanno portato alla necessità di registrare l'attività elettrocerebrale direttamente dal cervello. Ciò è realizzabile in due modi principali (v. Rossi e altri, 1982, e La registrazione ..., 1984): 1) applicando gli elettrodi registranti sulla superficie cerebrale messa allo scoperto mediante un'ampia craniotomia (elettrocorticografia o ECoG; v. tav. IV, 2); 2) introducendo elettrodi nella profondità del cervello, in corrispondenza di strutture cerebrali scelte in precedenza, mediante la metodologia stereotassica (stereoelettroencefalografia o SEEG; v. Bancaud e Talairach, 1965; v. figg. 11 e 33 e tav. IV,1; v. cap. 5, § c). Se il caso richiede registrazioni prolungate e ripetute, questi elettrodi possono essere opportunamente fissati e lasciati in sede per diversi giorni (registrazione cronica). Interessanti dati possono essere raccolti con microelettrodi capaci di registrare l'attività di singoli neuroni. Con gli elettrodi a diretto contatto con il cervello è inoltre possibile eseguire stimolazioni elettriche con l'intento di provocare crisi epilettiche; se le manifestazioni cliniche ed elettrografiche di queste crisi provocate sono uguali a quelle presentate spontaneamente dal paziente la sede dell'elettrodo stimolante coinciderà con quella della zona epilettogena: in ciò sta il valore diagnostico di queste stimolazioni. Queste manovre diagnostiche di registrazione e stimolazione dirette cerebrali, per la loro natura ovviamente invasiva, sono da attuarsi esclusivamente nei pazienti epilettici nei quali vi sia una precisa indicazione al trattamento chirurgico (v. cap. 6, È 1).
Un'altra possibilità diagnostica offerta dall'elettrofisiologia cerebrale consiste nello studio delle variazioni dell'attività elettrica del cervello provocate da stimoli intenzionali, o studio delle risposte evocate. In pratica, viene analizzata la risposta dei neuroni cerebrali a brevi scariche di impulsi provenienti da altri settori cerebrali o - come molto più di frequente si usa - dalla periferia (v. Rossini, 1983). In quest'ultimo caso, le scariche di impulsi centripeti sono provocate da singoli stimoli fisiologici, visivi o acustici o somestesici. L'analisi automatica del segnale registrato è, come vedremo, di grande importanza. Questo mezzo diagnostico viene applicato in neurochirurgia principalmente in caso di coma, nell'epilessia, nelle lesioni midollari e dei nervi periferici.
Da ricordare, infine, per quanto riguarda l'utilizzazione diagnostica dello studio dell'attività elettrica cerebrale, il grande contributo portato in tempi recenti dall'analisi automatica computerizzata (v. Dolce e Ktinkel, 1975). Ricorrendo a opportuni criteri di elaborazione matematica dei segnali elettrici registrati dal cervello secondo le modalità sopra riportate, è oggi possibile: 1) mettere in evidenza fenomeni altrimenti non visualizzabili (per es. perché mascherati nell'attività di fondo: esempio tipico quello delle risposte evocate); 2) trarre dall'attività elettrocerebrale molte più informazioni di quante non si ottengano con la semplice lettura a vista del tracciato registrato. L'analisi computerizzata dell'attività elettrocerebrale spontanea viene oggi largamente utilizzata per meglio seguire l'evolvere dello stato di coma. Molto interessante è la sua applicazione allo studio dei segnali elettrocerebrali di tipo epilettico: per es. valutazione quantitativa dell'attività epilettica nelle diverse strutture cerebrali; modalità di scarica nel tempo dei potenziali epilettici (v. i contributi di Rossi e altri, 1984); rapporti temporali tra potenziali epilettici registrati da strutture diverse (v. Rosadini e altri, 1974).
Lo studio elettrofisiologico dell'attività neuromuscolare comprende un altro gruppo di esami di rilevante interesse diagnostico neurochirurgico. I più utilizzati di tali esami sono l'elettromiografia (EMO) e l'elettroneuronografia per lo studio della velocità di conduzione dei nervi periferici (v. Smorto e Basmatian, 1972; v. Cohen e Brumlik, 1976). L'attività elettrica dei muscoli (elettrodi a placca sulla cute o ad ago infissi nel muscolo) può essere registrata quando il muscolo è a riposo oppure durante la sua contrazione volontaria o riflessa o prodotta da stimolazione elettrica del nervo motore. Per quanto riguarda l'attività elettrica dei nervi (elettrodi a placca sulla cute), siano essi nervi motori o nervi sensitivi, in pratica si tratta sempre di attività evocata da stimoli elettrici applicati in punti prossimali o distali dello stesso nervo o a livello delle sue terminazioni periferiche. Scopo di questi esami è di mettere in evidenza presenza e natura di alterazioni neuromuscolari, quali quelle conseguenti a lesioni del secondo motoneurone (corna anteriori del midollo, radice spinale anteriore, nervo motore periferico), della giunzione neuromuscolare, delle fibre muscolari, dei nervi della sensibilità. Questi mezzi diagnostici sono assai utili in neurochirurgia in diversi casi di patologia del midollo o delle radici spinali (per es. tumori, ernie discali, lesioni da traumi) e nella patologia traumatica dei nervi periferici; sono sempre regolarmente usati, inoltre, per controllare presenza e qualità dei fenomeni di rigenerazione dei nervi periferici dopo lesioni da trauma o altra causa morbosa o dopo anastomosi chirurgica.
e) Registrazione della pressione intracranica.
L'insieme delle cavità endocranica ed endorachidea costituisce un unico spazio chiuso. In condizioni fisiologiche la pressione media registrata all'interno di questo spazio, in soggetti in decubito perfettamente orizzontale, e uguale a tutti i suoi livelli, anche se, per ragioni fisiche, oscillazioni rapide di pressione dovute a cause endocraniche possono sfuggire a registrazioni effettuate a livello dell'estremità caudale di questo spazio (lombare). Nel soggetto normale, a riposo, questa pressione si aggira sui 100-150 mm H2O. Valori pressori medi che superino i 200 mm H2O (15 mm Hg) sono considerati abnormi. Tranne poche eccezioni, gli eventi sia fisiologici sia patologici che portano a variazioni di questa pressione hanno luogo a livello endocranico. Il rilevamento pressorio può essere eseguito a livello intracranico o a livello lombare, con metodi sempre invasivi (sola eccezione la non invasività del rilevamento effettuato per via transfontanellare nel neonato).
La misurazione della pressione a livello intracranico (o pressione intracranica propriamente detta) si esegue tramite ago-cannula o catetere inserito in un ventricolo cerebrale, oppure tramite speciali rilevatori inseriti tra la superficie interna della volta cranica e la superficie esterna del cervello, sotto o sopra l'involucro meningeo durale; queste procedure richiedono una piccola trapanazione cranica. Il segnale meccanico pressorio viene trasformato in segnale elettrico, opportunamente amplificato e quindi visualizzato su monitor o registrato su carta (v. Brock e Dietz, 1972; v. Lundberg e altri, 1975; v. Beks e altri, 1976; v. Rossi e altri, 1977; v. Shulman e altri, 1980). La registrazione e l'analisi della pressione intracranica sono mezzi atti, in certi casi addirittura indispensabili, a raggiungere la diagnosi in diverse condizioni morbose, le più rilevanti delle quali sono alcune forme di idrocefalia dell'infanzia e dell'adulto (per es. l'idrocefalo normoteso: v. cap. 6, § f) e sindromi di ipertensione endocranica benigna (quale lo pseudotumor cerebri: v. cap. 6, § d). Il monitoraggio della pressione intracranica è molto utile per seguire le condizioni del paziente e quindi per il suo corretto trattamento nelle ipertensioni endocraniche post-traumatiche (specie se accompagnate da stato di coma) e in certi decorsi postoperatori particolarmente delicati (specie dopo rimozione di tumori della fossa cranica posteriore). Di recente si è messo in evidenza che informazioni interessanti sulla genesi di alcuni quadri di idrocefalia sono ottenibili integrando il rilevamento della pressione media con quello della pressione pulsatile - cioè delle oscillazioni della pressione intracranica sincrone con il polso arterioso - e analizzando i rapporti tra le due pressioni (v. Di Rocco e altri, 1976). Molto utile l'elaborazione computerizzata dei segnali pressori.
La pressione a livello endorachideo viene di solito misurata tramite ago o catetere infisso nello spazio liquorale subaracnoideo lombare. Il suo rilievo può contribuire alla diagnosi della patologia endorachidea occupante spazio, consentendo di determinare l'esclusione del settore endorachideo posto caudalmente rispetto a detta patologia sulla base delle variazioni pressorie che avvengono rostralmente. Questa utilizzazione, tuttavia, è oggi rara, dato il progresso della diagnostica radiologica (v. cap. 4). La misurazione a livello lombare della pressione entro lo spazio endorachideo-endocranico (se non vi sono ostacoli di comunicazione fra l'uno e l'altro) viene oggi utilizzata in neurochirurgia per lo studio del rapporto volume/pressione del liquido cefalorachidiano. L'esame, proposto da Katzman e Hussey nel 1970, si basa sull'analisi del comportamento della pressione liquorale in rapporto all'infusione continua nel circolo liquorale di una quantità di soluzione fisiologica (o liquor artificiale) pari al doppio della produzione normale di liquor. È in tal modo possibile valutare la capacità di assorbimento liquorale, dalla cui alterazione prendono origine alcune sindromi di idrocefalia con più o meno marcato aumento della pressione intracranica (per es. idrocefalie post-traumatiche o postemorragiche o postmeningitiche).
f) Ecografia.
Questo mezzo diagnostico si basa sul fatto che ultrasuoni emessi da un adeguato generatore vengono riflessi quando incontrano piani strutturalmente diversi. Opportunamente rilevati, questi ultrasuoni riflessi (‛eco') possono indicare disfunzioni della normale strutturazione spaziale del contenuto endocranico o la presenza di masse abnormi. Il termine fu coniato nel 1956 da Leksell, che riuscì a dimostrare lo spostamento laterale delle strutture della linea mediana in casi di traumi cranio-encefalici (v. Leksell, 1955-1956 e 1958). Sviluppatasi tecnicamente in modo considerevole negli anni seguenti, questa metodologia non invasiva, di attuazione relativamente rapida, trova oggi applicazione pratica in diversi campi (v. Uematsu e Walker, 1970), i più importanti dei quali per il neurochirurgo sono: 1) traumatologia cranio-encefalica, per il rilevamento di ematomi formatisi immediatamente dopo il trauma o a distanza di tempo (esami sequenziali); 2) idrocefalo di varia natura e altre alterazioni degli spazi liquorali endocranici, ad esempio su base malformativa; 3) precisazione della localizzazione di raccolte ematiche o di tumori cerebrali profondi durante intervento chirurgico (v. Müller, 1971); 4) lo studio del flusso arterioso e venoso mediante una tecnica che utilizza l'effetto Doppler (metodologia usata largamente per rilevare stenosi o occlusioni a livello del circolo extracranico; v. Strandness, 1978). Da ricordare, infine, la possibilità offerta dall'ecoencefalografia di rilevare malformazioni prima della nascita, quando il feto è ancora nell'utero.
g) Risonanza magnetica nucleare.
È l'ultimo nato degli esami strumentali capaci di fornire ottime immagini delle strutture cerebrali e midollari normali e patologiche. Il principio su cui si basa l'esame (v. Partain e altri, 1982) è completamente diverso da quello sia della radiologia sia della medicina nucleare: la differenziazione tra i vari tessuti è data da differenze della densità e dei tempi di rilassamento protonici, rilevabili sottoponendo i tessuti stessi a un campo magnetico e all'invio di onde elettromagnetiche a bassa frequenza. Le immagini ottenute consentono non solamente valutazioni strutturali, ma anche biochimiche, sia qualitative che quantitative. I settori corporei esaminati possono essere visti in sezione nei piani assiale, coronale e sagittale, variando opportunamente la direzione del campo magnetico. L'esame, a tecnologia molto sofisticata e costosa, è ancora in via di sviluppo; esso sembra di particolare importanza non tanto per lo studio morfologico delle strutture nervose cerebrali o midollari, anche se fornisce immagini di ottima qualità, quanto perché consente di ottenere informazioni sulle caratteristiche costitutive dei tessuti, specie di quelli patologici. (V. anche risonanza magnetica nucleare).
h) Biopsia.
Nella logica sequenza applicativa dei mezzi diagnostici oggi accessibili al neurochirurgo, la biopsia si configura come il tipo di esame cui ricorrere dopo che tutti gli altri sono stati espletati, ma non sono stati sufficienti a raggiungere la completezza diagnostica necessaria alla scelta della terapia più appropriata e alla sua corretta applicazione. Ovviamente invasiva, la biopsia è un vero e proprio intervento chirurgico, usato però a scopo diagnostico anziché a scopo terapeutico. Essa consiste nel prelievo di frammenti di tessuto patologico di cui si voglia conoscere con esattezza le caratteristiche, mediante adeguato esame anatomomicroscopico, ed è utilizzata soprattutto per la patologia endocranica, in grado minore per quella midollare e nervosa periferica. Vi sono casi in cui gli altri mezzi diagnostici disponibili, clinici e strumentali, permettono di mettere in evidenza l'esistenza di una patologia cerebrale, la sua sede e la sua estensione, ma non la sua natura. Una delle prime indicazioni della biopsia è appunto quella di chiarire questa natura. Il suo più comune campo di applicazione è quello oncologico; di frequente accade che gli altri mezzi diagnostici rivelino un tumore cerebrale, ma non siano atti a precisarne le caratteristiche oncologiche. Se il tumore è comunque accessibile chirurgicamente, la conoscenza di queste caratteristiche non è indispensabile; se, viceversa, il tumore non è chirurgicamente asportabile, questa conoscenza diventa assolutamente necessaria per decidere la possibilità e il tipo di terapie alternative, quali la chemioterapia, la radioterapia percutanea e, soprattutto, la radioterapia interstiziale.
Il prelievo bioptico di tessuti patologici cerebrali può venire attuato in due modi: 1) secondo le modalità neurochirurgiche classiche, cioè con craniotomia più o meno ampia; 2) secondo la metodologia stereotassica (v. cap. 5), cioè inserendo, mediante un apparecchio stereotassico e attraverso un piccolo foro di trapanazione, sottili strumenti capaci di raggiungere con precisione il processo patologico (visualizzato con esami radiologici adeguati) e di prelevarne dei frammenti. Questa seconda modalità offre i vantaggi di un trauma minore e permette di raggiungere processi patologici in ogni parte del cervello, anche le più profonde, praticamente senza danneggiare le strutture cerebrali più superficiali. Per queste ragioni, il ricorso alla cosiddetta ‛biopsia stereotassica' è aumentato considerevolmente in tempi recenti (v. Scerrati e Rossi, 1984).
5. Le modalità del trattamento.
Nel trattamento del paziente candidato a un intervento neurochirurgico è possibile riconoscere tre fasi principali: 1) una prechirurgica, o preparatoria; 2) una chirurgica, cioè l'intervento vero e proprio; 3) l'ultima postchirurgica, che, in casi particolarmente delicati, si identifica con la cosiddetta terapia intensiva e per i casi molto gravi con la rianimazione. Per la fase prechirurgica è assai importante la collaborazione del neurochirurgo con gli internisti; per le fasi chirurgica e postchirurgica è indispensabile la collaborazione rispettivamente con l'anestesista e con il nanimatore. Quest'ultima collaborazione è talmente importante che ha portato alla differenziazione nell'ambito dell'anestesia e rianimazione di superspecialisti chiamati neuroanestesisti e neurorianimatori. Pur sottolineando l'importanza che hanno, per un efficiente trattamento neurochirurgico, tutte e tre le fasi sopra ricordate, il presente capitolo verrà dedicato alla seconda di esse, quella cioè di più stretta competenza del neurochirurgo (v. Poppen, 1960; v. David e altri, 1961; v. Mullan, 1961; v. Davis e Davis, 1963; v. Kempe, 1968; v. Matson, 1969; v. Yasargil, 1969; v. Jennett, 1970; v. Northfield, 1973; v. Milhorat, 1978; v. Pagni, 1978; v. Rand, 1978; v. Youmans, 1982; v. Howe, 1983; v. Morello e Pluchino, 1983; v. Schmideck e Sweet, 1983).
a) Finalità.
La neurochirurgia, così come altre branche della chirurgia, può affrontare l'atto chirurgico terapeutico con due finalità principali (v. tab. IV): 1) distruggere o asportare tessuti (nervosi, meningei, ossei, vascolari) danneggiati o malformati; 2) riparare tessuti o strutture lesi, oppure correggere o compensare una funzione alterata, applicando protesi, oppure, infine, esaltare la funzione di strutture nervose intatte al fine di compensare la funzione di altre strutture nervose danneggiate dalla malattia (la cosiddetta neurochirurgia ricostruttiva o ‛aumentativa'; v. Sedan e Lazorthes, 1978; v. Siegfried e Hood, 1983). Esempi ovvi di queste due finalità di trattamento sono per la chirurgia demolitiva l'asportazione di un tumore, per la chirurgia ricostruttiva l'anastomosi dei due monconi di un nervo sezionato. Un elenco dei campi di applicazione più comuni di queste due modalità di intervento neurochirurgico è riportato nella tab. IV. Sui più importanti di questi campi di applicazione torneremo nel cap. 6.
Ancora nella tab. IV sono elencati i mezzi di cui il neurochirurgo si avvale per l'esecuzione dei suoi interventi, rispettivamente demolitivi e ricostruttivi. Come si vede, oltre a quelli tradizionali, più o meno comuni a tutta la chirurgia, sono oggi disponibili mezzi molto particolari. Per quanto riguarda i mezzi demolitivi, la scelta dell'uno o dell'altro dipende sostanzialmente dal tipo o dalla natura della patologia da trattare e dalla sua situazione topografica; non esiste un solo mezzo che sia ottimale per tutti gli interventi. Lo stesso dicasi per i mezzi ricostruttivi, e a questo riguardo sembra opportuno precisare alcuni punti: 1) per quanto concerne le protesi, esse non vanno intese come strutture artificiali capaci di sostituire parti danneggiate del sistema nervoso; esse sono utilizzate per riparazioni di parti ossee o meningee, oppure per ristabilire la circolazione liquorale (per es. derivazioni del liquor da un ventricolo cerebrale alla cavità peritoneale mediante cateteri particolari connessi con una valvola unidirezionale a pressione di apertura prestabilita; v. Nulsen e Spitz, 1971) o ematica (per es. sostituzione di un segmento di arteria con segmenti di materiale tubolare artificiale); 2) per quanto concerne la stimolazione elettrica, essa si basa sul principio di attivare - appunto con appropriati impulsi elettrici - una certa funzione nervosa, capace di controbilanciarne un'altra alterata o esaltata abnormemente dalla malattia (esempio tipico il dolore; v. cap. 6, § 1): ciò si ottiene impiantando adeguati elettrodi stimolanti in strutture cerebrali o midollari particolari e connettendoli con un generatore di impulsi programmabile interno (cioè inserito nel tessuto sottocutaneo) o esterno; 3) infine, per quanto riguarda la trapiantistica, i soli trapianti oggi possibili in neurochirurgia sono quelli dei nervi periferici, mentre trapianti a livello del cervello o del midollo spinale non sembrano attualmente possibili; è in corso di studio, tuttavia, il trapianto - o meglio l'innesto - di cellule biologicamente attive in alcuni settori cerebrali (v. Björklund e altri, 1980; v. chirurgia dei trapianti, suppl.).
c) Tipo di approccio.
Infine, sempre nella tab. IV, vengono ricordate le tre principali modalità di applicazione (o tipi di approccio) dei mezzi disponibili per conseguire le finalità del trattamento neurochirurgico. La modalità definita ‛tradizionale' è stata la prima ed è rimasta l'unica fino alla metà del secolo presente; è ancora oggi quella più usata. La patologia da trattare viene raggiunta dopo apertura sufficientemente ampia della cavità del cranio (o del rachide) e delle meningi; se detta patologia è profonda, è necessario aprirsi un passaggio attraverso i settori superficiali del cervello (o del midollo).
L'uso del microscopio operatorio, la cui applicazione alla neurochirurgia risale agli inizi degli anni sessanta, ha portato a un potenziamento di enorme importanza delle possibilità del trattamento neurochirurgico (v. Yasargil, 1969; v. Rand, 1978). Sostanzialmente, i criteri generali dell'intervento rimangono quelli tradizionali, ma operando con l'aiuto del microscopio si conseguono i seguenti vantaggi: 1) riduzione considerevole del trauma chirurgico (per es.: lembi operatori molto piccoli; possibilità di maneggiare con cautela e minor rischio di rottura aneurismi o angiomi; rispetto di strutture nervose e vascolari sane nelle vicinanze della patologia da rimuovere); 2) miglior controllo della completezza dell'asportazione dei tessuti patologici (per es. tumori); 3) possibilità di eseguire operazioni su strutture assai minute (per es. sutura di nervi e vasi di 1 mm di calibro: v. tav. I,4). Parallelamente all'estendersi dell'uso del microscopio operatorio vi è stata la produzione di strumenti chirurgici idonei, particolarmente fini e delicati.
Infine, l'approccio neurochirurgico stereotassico. Come già accennato nel capitolo sulla diagnostica, ciò che caratterizza la stereotassia è la possibilità di raggiungere con strumenti idonei a effettuare il trattamento desiderato (distruttivo o ricostruttivo-aumentativo) qualsiasi parte del cervello e del midollo spinale senza ricorrere a un'esposizione diretta (come nell'approccio tradizionale e in quello che utilizza il microscopio operatorio). La metodologia stereotassica fu ideata all'inizio del secolo per studi sperimentali sul cervello da D. Horsley e R. H. Clarke, e le sue prime applicazioni alla chirurgia cerebrale nell'uomo risalgono al decennio 1940-1950 (v. Spiegel e altri, 1947). Sono stati realizzati diversi apparecchi, detti stereotassici, la cui caratteristica comune è quella di venir fissati alla testa del paziente come un casco (v. tav. IV,1). Ogni parte dell'apparecchio ha quindi un rapporto ben preciso con una parte del contenuto cranico. Procedendo alla visualizzazione delle componenti cerebrali normali o patologiche con opportune tecniche radiologiche (TAC, ventricolografia, angiografia; v. cap. 4, § b), nel paziente con l'apparecchio stereotassico già applicato, è possibile definire con accuratezza i rapporti specifici apparecchio-strutture cerebrali o apparecchio-processo patologico cerebrale. Di conseguenza, uno strumento atto a produrre lesioni o stimolazione elettrica o chimica o a registrare l'attività elettrocerebrale, montato sull'apparecchio stereotassico, può essere, con calcoli relativamente semplici, orientato opportunamente e quindi - previa piccola trapanazione cranica - infisso nel cervello fino a raggiungere il traguardo desiderato. L'uso del calcolatore facilita i necessari calcoli per una corretta valutazione dei rapporti spaziali apparecchio stereotassico-cervello e per il corretto orientamento dello strumento da introdurre nel cervello. Simili sono i principi della stereotassia applicata al rachide-midollo.
Sul piano diagnostico, come già ricordato (v. cap. 4, §§ d, h), la metodologia stereotassica trova le sue principali applicazioni nella registrazione dell'attività elettrica di strutture cerebrali profonde nell'epilessia (stereoelettroencefalografia o SEEG) e nella biopsia di tumori cerebrali. Sul piano terapeutico le più importanti applicazioni sono: sindromi dolorose e sindromi distonico-discinetiche (lesioni e stimolazioni, cerebrali o midollari); epilessia (lesioni cerebrali); tumori (curieterapia) (v. cap. 6, §§ i, l, m, d).
6. I campi di applicazione.
Un elenco dei campi di applicazione della neurochirurgia è riportato nella tab. V. La tabella non pretende di fornire la lista completa di tutte le forme morbose trattabili neurochirurgicamente, ma di quelle di più comune riscontro. La suddivisione nelle varie patologie segue criteri soprattutto pratici, in parte eziologici, in parte sintomatologici o clinici, ed è quella che si riscontra nella maggior parte della trattatistica (v. David e altri, 1961; v. Mullan, 1961; v. Davis e Davis, 1963; v. Kempe, 1968; v. Matson, 1969; v. Jennett, 1970; v. Northfield, 1973; v. Milhorat, 1978; v. Pagni, 1978; v. Youmans, 1982; v. Howe, 1983; v. Morello e Pluchino, 1983; v. Schmideck e Sweet, 1983). Le cause, o eziologia, delle patologie riportate nella tab. V sono precisate nella tab. VI.
Nelle pagine che seguono verranno commentati quegli aspetti delle varie forme morbose, di cui alla tab. V, che più sono utili a far comprendere il ruolo attuale della neurochirurgia nei campi assistenziale, scientifico e sociale.
a) Malformazioni non vascolari.
La grande maggioranza delle malformazioni cranio-encefaliche e vertebro-midollari interessano la linea mediana (v. Gardner, 1973; v. Vinken e Bruyn, 1977; v. Mc Laurin, 1977; v. Macchi, 1981; v. Di Rocco e Caldarelli, 1983). Esse sono la conseguenza di alterazioni della embriogenesi che possono verificarsi in epoche diverse della crescita dell'embrione, in particolare durante la 3a-4a settimana, o stadio della neurulazione (meningocele, encefalomeningocele, mielomeningocele, mielorachischisi), e la 5a-9a settimana, o stadio della differenziazione del rafe dorsale (spina bifida occulta, atresia dell'acquedotto di Silvio, sindrome di Arnold-Chiari, sindrome di Dandy-Walker). Possono essere contemporaneamente interessati sistema nervoso, meningi, ossa e cute. La più frequente di queste malformazioni, il mielomeningocele, colpisce approssimativamente 2 neonati su 1.000 (v. 14 e tav. II,1). L'entità della malformazione e la gravità del quadro clinico relativo sono variabili, andando da gradi estremi - non compatibili con la sopravvivenza - a gradi assai lievi. La problematica clinica è in rapporto al tipo e alla sede della malformazione. Così, ad esempio, il mielomeningocele lombare può comportare il disturbo della motilità degli arti inferiori e del controllo degli sfinteri; la stenosi dell'acquedotto porta a idrocefalia e, quindi, a ipertensione endocranica (v. sotto, § f); ecc. La correzione chirurgica è possibile nella maggioranza dei casi. La tendenza attuale è di operare immediatamente dopo la nascita. Scopi dell'intervento sono: impedire la altrimenti inevitabile infezione là dove non vi sia integrità dei tegumenti interessati dalla malformazione; ripristinare una posizione per quanto possibile normale, all'interno del cranio o del rachide, delle strutture nervose funzionanti; eliminare ogni elemento di compressione o distorsione che possa compromettere lo sviluppo del sistema nervoso a mano a mano che il bambino cresce.
Un considerevole progresso è stato raggiunto nel trattamento delle malformazioni del cranio. La precoce ossificazione delle suture craniche (craniostenosi, nelle sue varie forme: v. tav. III,1) ostacola la normale espansione del cranio stesso e, quindi, il cervello viene a essere compresso; ne risentono sia lo sviluppo psichico del bambino sia quello delle funzioni motorie. Anche in questo tipo di patologia malformativa quanto più precoce è l'intervento neurochirurgico correttivo, tanto maggiori sono le possibilità di successo (v. Galli, 1984). Più complesso è il problema del trattamento quando la craniostenosi si combina con alterazioni dello sviluppo della struttura ossea facciale (v. Maniscalco e Habal, 1982). Da ricordare che a queste malformazioni possono associarsene altre di altri distretti corporei, per esempio le estremità o il cuore, in questo caso rendendo necessaria la collaborazione del neurochirurgo con altri specialisti.
Una delle principali conseguenze cliniche delle facomatosi interessanti il cervello e delle cisti leptomeningee (v. Youmans, 1982) è l'epilessia (v. sotto, § i). La sindrome di Sturge-Weber, consistente nell'associazione di un'angiomatosi cutanea nel territorio trigeminale con un'angiomatosi cerebro-leptomeningea, entrambe unilaterali, spesso fonte di gravissima epilessia, è oggi trattabile con uno degli interventi più demolitivi della neurochirurgia, la cosiddetta emisferectomia. L'intervento consiste nell'asportazione di tutta o quasi tutta la parte telencefalica dell'emisfero cerebrale colpito (v. tav. III, 2). I risultati sono ottimi. Questo intervento, che avrebbe effetti devastanti sulle capacità funzionali cerebrali, se eseguito nell'età adulta, è molto ben tollerato nella prima infanzia, quando ancora il cervello è dotato di grande plasticità e capacità di compenso. Sempre tra le facomatosi, è da ricordare la neurofibromatosi multipla (o morbo di Recklinghausen), che colpisce i tronchi nervosi. Essa diviene suscettibile di trattamento neurochirurgico quando i neurofibromi causano dolori o, acquisendo dimensioni cospicue, comprimono strutture vicine, come può accadere soprattutto quando interessano i nervi encefalici.
b) Malformazioni vascolari.
Gli aneurismi arteriosi endocranici e le malformazioni artero-venose (o angiomi), endocranici ed endorachidei, sono stati per lungo tempo considerati patologie tra le più difficili da trattare chirurgicamente. La precisazione della definizione diagnostica (angiografia; v. cap. 4) e, soprattutto, l'uso del microscopio operatorio (v. cap. 5), combinati con i progressi dell'anestesiologia, hanno accresciuto moltissimo le possibilità di trattamento, riducendone contemporaneamente i rischi. Tuttavia, il trattamento di queste malformazioni rimane ancora uno dei compiti più impegnativi della neurochirurgia.
Nella grande maggioranza dei casi gli aneurismi delle arterie endocraniche (v. Pool e Potts, 1965; v. Yasargil e altri, 1975; v. Drake, 1976) si rendono clinicamente evidenti quando si rompono (si calcola che ogni anno all'incirca 1-2 persone su 10.000 vadano incontro a emorragia endocranica per rottura di aneurisma). Ciò accade nell'età adulta, molto raramente nell'infanzia, forse in rapporto a fenomeni regressivi della parete aneurismatica. Dato che quasi tutti questi aneurismi si sviluppano a livello dei segmenti prossimali delle arterie endocraniche, allogate nelle cisterne della base cranica, interemisferica e silviana, la loro rottura porta all'invasione ematica degli spazi liquorali. La manifestazione clinica che ne consegue è rappresentata dalla sindrome di emorragia subaracnoidea: improvvisa e violenta cefalea, segni di irritazione meningea (come la rigidità nucale) accompagnati, nei casi più gravi, da obnubilamento della coscienza. Se l'emorragia interessa anche il parenchima cerebrale, possono associarsi segni di lesione cerebrale (quali deficit motori, sensitivi o del linguaggio, a seconda della sede dell'emorragia). In quest'ultimo caso, se l'invasione emorragica del cervello è cospicua, l'intervento chirurgico si configura come intervento urgente: esso ha come scopo principale e immediato la liberazione del cervello dalla massa ematica (o ematoma) che, come un tumore, comprime e danneggia le circostanti strutture cerebrali sane. Secondo scopo del trattamento neurochirurgico - o unico scopo nei casi in cui non vi sia stata emorragia intracerebrale (i più frequenti) - è l'eliminazione dell'aneurisma. Questa finalità neurochirurgica nasce dalla dimostrazione su base statistica che, nella grande maggioranza dei casi sopravvissuti alle conseguenze della rottura di un aneurisma, la prima rottura è seguita da rotture successive. In questi pazienti il trattamento neurochirurgico si configura quindi come trattamento preventivo, diretto cioè a impedire le successive emorragie. L'aneurisma deve essere eliminato o escluso dal circolo. Ciò è ottenibile, nella maggior parte dei casi, occludendo il cosiddetto ‛colletto' aneurismatico, cioè il peduncolo o segmento di impianto della sacca aneurismatica sull'arteria parente. Nei pochi casi non accessibili chirurgicamente è possibile tentare l'esclusione dell'aneurisma introducendo nell'arteria di origine cateteri terminanti con un piccolo palloncino che può essere gonfiato e lasciato in loco (v. Serbinenko, 1974).
Le malformazioni artero-venose, o angiomi, sono gomitoli di vasi di varie dimensioni, in genere situati in corrispondenza degli emisferi cerebrali (v. Pool e Potts, 1965; v. Mingrino, 1978), più raramente del midollo (v. Malis, 1982; v. tav. II, 2). Attraverso questa moltitudine di vasi abnormi il sangue arterioso passa direttamente nelle vene di scarico, non essendovi la normale interposizione dei capillari. Questo shunt artero-venoso altera l'emodinamica, dapprima localmente, poi - ingrossandosi il calibro sia dei vasi della malformazione sia delle arterie a questa afferenti e delle sue vene efferenti, per l'abnorme quantità di sangue in essi circolante - anche in zone distanti del cervello e del midollo. Ne consegue un insufficiente apporto di sangue al tessuto nervoso. Con il passare del tempo, quasi sempre nell'età adulta, si rendono evidenti le conseguenze cliniche del fenomeno. Negli angiomi cerebrali queste manifestazioni cliniche spesso sono di tipo epilettico, più raramente di tipo deficitario (per es. paresi); negli angiomi midollari esse sono solamente deficitarie. La malformazione può anche rompersi e dar luogo a emorragia cerebrale o midollare, spesso assai grave. Il trattamento elettivo è quello chirurgico, consistente nell'asportazione della malformazione. Alternativamente, nei casi in cui l'aggressione chirurgica diretta o non sia possibile (per es. in alcune malformazioni profonde) o sia troppo rischiosa, si può ricorrere all'occlusione dei vasi malformati mediante embolizzazione. Questa procedura, da eseguire sotto continuo monitoraggio radiologico, consiste nell'immettere nelle arterie alimentanti la malformazione, attraverso cateterismo arterioso, particelle (per es. sfere di plastica) di calibro da scegliersi che, portate dalla stessa corrente ematica, raggiungono i vasi anomali e li occludono (v. Doppman e altri, 1971). Manovra certamente rischiosa, in mani capaci può dare risultati molto buoni. In alcuni casi essa viene attuata come preparazione al successivo intervento chirurgico, che ne viene facilitato. Altra possibilità di trattamento è la sclerotizzazione dei vasi anomali con radiazioni, possibilità però che ha dato scarsi risultati, tranne che in casi molto selezionati di angiomi di piccole dimensioni e usando modalità di irradiazione del tutto particolari (v. Steiner e altri, 1972; v. Backlund, 1979).
Differente dalle precedenti malformazioni vascolari è l'aneurisma della vena di Galeno, malformazione aneurismatica venosa che si rende clinicamente evidente fino dalla prima infanzia. Per le sue grandi dimensioni la malformazione può comprimere le strutture cerebrali vicine, e può - in modo molto più grave di quanto accade nelle malformazioni artero-venose - produrre alterazioni dell'emodinamica così rilevanti da ripercuotersi addirittura a livello cardiaco.
Infine, si ricordano le malformazioni delle grandi arterie alimentanti il circolo cerebrale, carotidi interne e vertebrali, a livello cervicale, prima cioè del loro ingresso nel cranio. La più comune di queste malformazioni consiste in una abnorme lunghezza con inginocchiamento (kinking): questa anormalità può costituire ostacolo al passaggio del sangue e, quindi, portare a insufficienza circolatoria cerebrale, fenomeno che si verifica solitamente nell'età adulta, probabilmente favorito da fatti degenerativi della parete arteriosa.
c) Traumi.
Le lesioni da trauma del sistema nervoso nei suoi settori cerebrale, midollare e periferico costituiscono uno dei principali campi di applicazione della neurochirurgia, un campo nel quale vengono affrontati interessanti e impegnativi problemi scientifici e assistenziali con importanti implicazioni medico-sociali, dovute, soprattutto, alla frequenza di tale tipo di patologia (v. Caveness, 1979): si calcola, infatti, che nei paesi a sviluppo avanzato ogni anno una persona su mille venga ricoverata in ospedale per un trauma al capo o alla colonna vertebrale. La maggior parte di questi traumi è dovuta a incidenti di traffico, nel 70% dei quali viene colpita la testa o la colonna. In almeno la metà dei traumatizzati deceduti per incidenti di traffico è il trauma alla testa (trauma cranio-encefalico) il fattore responsabile del decesso. Un dato particolarmente impressionante è che i traumi cranio-encefalici sono la più frequente causa di morte nella popolazione tra i 15 e i 25 anni. Di difficile valutazione il numero o la percentuale di coloro che, avendo subito un trauma cranio-encefalico o vertebro-midollare, non muoiono, ma restano invalidi. Le implicazioni medicosociali ed economiche di questi dati sembrano ovvie.
Dal punto di vista dell'assistenza sanitaria possono distinguersi tre momenti: 1) il trattamento del traumatizzato in fase acuta, cioè subito dopo il trauma; 2) il trattamento delle complicanze tardive, che insorgono giorni, settimane, mesi e anche anni dopo il trauma (come, ad esempio, può accadere per l'epilessia post-traumatica); 3) il trattamento riabilitativo, tendente a recuperare o compensare i danni insorti acutamente o tardivamente. La neurochirurgia ha un ruolo essenziale o comunque assai importante in tutti e tre i momenti terapeutici ora menzionati (v. Bricolo e altri, 1968; v. Walker e altri, 1969; v. Selecki e Williams, 1970; v. Visalli, 1972; v. Vinken e Bruyn, 1975; v. Mc Laurin, 1976; v. Caveness, 1979; v. Popp, 1979; v. Omer e Spinner, 1980; v. Vigouroux e Guillermain, 1981; v. Clark, 1982; v. Morello e Pluchino, 1983).
I problemi dell'assistenza a un traumatizzato nella fase acuta possono essere quanto mai vari, in rapporto alla varietà dei danni che il trauma può produrre. Una prima, semplice distinzione viene fatta tra traumi ‛aperti' e traumi ‛chiusi'. Nei traumi aperti vi è rottura con discontinuità delle parti cutanee e ossee (cranio o rachide) e frammenti dell'osso fratturato possono infiggersi nel tessuto cerebrale o midollare, o comprimerlo: si stabilisce una comunicazione tra l'esterno e il sistema nervoso. Nei traumi chiusi non vi è questa comunicazione. Per quanto riguarda i danni al sistema nervoso, sempre come conseguenza immediata del trauma, si usa riconoscere: 1) un danno transitorio, reversibile, senza alterazioni organiche dimostrabili, o ‛commozione'; clinicamente esso si traduce in una immediata, ma transitoria (minuti o ore), perdita di coscienza (commozione cerebrale) o sospensione delle funzioni midollari (commozione o shock midollare) o dei nervi periferici; 2) un danno permanente, senza però discontinuità del tessuto nervoso, o ‛contusione'; clinicamente esso porta a fenomeni deficitari, in parte almeno permanenti, dell'una o dell'altra funzione cerebrale o midollare o dei nervi periferici, a seconda della sede della contusione; 3) ancora un danno permanente, ma con discontinuità del tessuto nervoso (‛lacerazione' per il sistema nervoso centrale, ‛sezione' o ‛strappamento' per il sistema nervoso periferico); 4) infine, quando lo spandimento emorragico è consistente, ‛emorragia' o ‛ematoma'. Da ricordare che elemento comune a ogni tipo di lesione traumatica del tessuto nervoso è l'edema locale. La diagnosi corretta del danno prodotto dal trauma non è difficile, combinando le notizie cliniche con la diagnostica strumentale (soprattutto radiologica, per i traumi cranio-encefalici e vertebro-midollari, ed elettrofisiologica, per i traumi dei nervi periferici; v. cap. 4, §§ b, d). Clinicamente i danni di cui ai punti 2, 3 e 4 consistono in fenomeni deficitari, in parte almeno permanenti, dell'una o dell'altra funzione cerebrale o midollare o periferica, in rapporto alla sede e all'estensione del danno; nei traumi cranio-encefalici, per lesioni estese, i fenomeni deficitari focali possono accompagnarsi a perdita di coscienza di lunga durata o coma. Altra possibile evenienza nei traumi cranici è che non vi siano manifestazioni cliniche immediate ma che, dopo alcune ore o qualche giorno (il cosiddetto ‛intervallo libero'), insorgano cefalea, difficoltà nei movimenti, disturbi della sensibilità degli arti di un lato, disturbi del linguaggio, con tendenza al progressivo aggravamento, e, infine, perdita di coscienza: è questa la tipica conseguenza del formarsi graduale di una raccolta ematica, o ematoma, tra la superficie esterna del cervello e la superficie interna del cranio (ematoma sottodurale, di origine venosa, o sopradurale, di origine arteriosa, a seconda dei suoi rapporti con l'involucro meningeo durale).
È assolutamente necessario che il traumatizzato che ha subito un trauma cranio-encefalico o vertebro-midollare sia subito trasportato là dove possa essere adeguatamente assistito. Non vi è dubbio che il modo più efficace per ridurre significativamente l'alto livello di mortalità da traumi del sistema nervoso e le gravose conseguenze limitative nei sopravvissuti sia quello di migliorare l'assistenza in questa fase acuta. A tal fine è necessario disporre di mezzi per il trasporto immediato (ambulanza o elicottero, a seconda del luogo del trauma e delle caratteristiche geografiche del paese) a un centro ospedaliero dove siano prontamente disponibili i mezzi diagnostici neuroradiologici, una buona organizzazione neurochirurgica e un valido servizio di rianimazione (v. rianimazione). Va sottolineato che per molte delle lesioni traumatiche cerebrali o midollari ritardi anche relativamente brevi, per esempio di un'ora, nel trasporto, nella diagnosi o nell'esecuzione dell'intervento possono rendere la lesione irreversibile quando non addirittura mortale. Viceversa il trattamento immediato può dare un completo ripristino funzionale. Meno urgente è il trattamento delle lesioni dei nervi periferici. Esse vengono definite diagnosticamente integrando un accurato esame clinico con esami elettrofisiologici. Grazie all'uso del microscopio operatorio è oggi possibile la ricostruzione di nervi sezionati o strappati a causa del trauma (v. Samii, 1975). Se si tratta di nervi a funzione motoria, dal moncone prossimale del nervo ricostituito chirurgicamente si rigenerano fibre che raggiungono il muscolo, reinnervandolo: i risultati, sul piano funzionale, possono essere ottimi (v. Microchirurgia ricostruttiva, in chirurgia). Importante la collaborazione del fisiochinesiterapista.
Una delle più temibili tra le complicanze tardive o sequele di un trauma cranio-cerebrale è l'epilessia. Essa è dovuta al disturbo metabolico, e quindi funzionale, di una zona della corteccia cerebrale, causato da una cicatrice encefalica o meningo-encefalica, quale può svilupparsi là dove vi è stata contusione e soprattutto lacerazione cerebrale. Questo disturbo può svilupparsi in tempi assai lunghi, anche anni. Il trattamento chirurgico si impone se le crisi epilettiche non sono controllabili con i farmaci (v. sotto, § i). Un'altra possibile complicanza tardiva (settimane o mesi) di interesse neurochirurgico è la sindrome di idrocefalo normoteso. Questo particolare tipo di idrocefalo (v. sotto, § f) è dovuto a un difetto di assorbimento del liquor a livello delle granulazioni del Pacchioni della convessità cerebrale, sderotizzate come conseguenza di uno spandimento emorragico prodotto dal trauma. La diagnosi si basa sullo studio morfologico dei ventricoli cerebrali (TAC o ventricolografia; v. cap. 4, § b) e della dinamica liquorale (cisternoscintigrafia; pressione intracranica; rapporto volume/pressione liquorale; v. cap. 4, §§ c, e).
Infine il trattamento riabilitativo. Il neurochirurgo può intervenire utilmente per correggere o compensare alcune delle menomazioni neurologiche del traumatizzato soprattutto utilizzando la stimolazione elettrica delle colonne dorsali del midollo spinale. Metodologia terapeutica di recente introduzione (v. cap. 5), essa ha dato i risultati migliori nel trattamento della spasticità degli arti inferiori e nella paralisi vescicale (vescica neurologica) conseguenti a lesioni del midollo spinale (v. sotto, § m). In questi casi la collaborazione rispettivamente con il fisioterapista e con l'urologo é indispensabile.
d) Tumori.
Sono considerati di pertinenza neurochirurgica tutti i tumori che compromettono il sistema nervoso: tali tumori possono prendere origine non solamente dagli elementi costitutivi del sistema nervoso stesso, ma anche dalle strutture entro le quali il cervello, il midollo spinale e i nervi sono racchiusi o avvolti (il cranio e il rachide, le meningi, le guaine dei nervi periferici), da strutture non nervose contenute entro il cranio o il rachide (per es. la ghiandola ipofisaria, le strutture vascolari, resti embrionali) e, infine, dalla propagazione per contiguità o per via ematica (metastasi) di cellule di tumori di altri distretti corporei. Almeno una persona su diecimila è colpita ogni anno dall'uno o l'altro di questi tumori. Considerati globalmente, essi rappresentano circa il 9% di tutte le forme tumorali neoplastiche del corpo umano (v. Russel e Rubinstein, 1963). È verosimile, tuttavia, che questi dati epidemiologici siano inferiori al reale; in effetti, a mano a mano che progrediscono, i mezzi diagnostici consentono di rivelare processi tumorali prima non riconoscibili e portano a ritocchi in aumento delle cifre di cui sopra.
Gli oncotipi principali sono elencati nella tab. VII, derivata dalla classificazione elaborata dall'Organizzazione Mondiale della Sanità (v. Zülch, 1979 e 1980). La tab. VIII riporta schematicamente, per gli oncotipi più comuni e limitatamente ai tumori a sede endocranica, la distribuzione per età e la frequenza relativa. Come si vede, alcuni tumori sono caratteristici dell'infanzia (per es. il medulloblastoma, tumore che colpisce tipicamente il cervelletto), altri prevalentemente dell'età adulta (glioblastomi, meningiomi, metastasi). I tumori della serie gliale, considerati nel loro complesso (ependimomi, astrocitomi, oligodendrogliomi e glioblastomi), rappresentano all'incirca la metà di tutti i tumori endocranici.
Nella tab. VII, accanto a ogni tipo di tumore, viene indicato il grado di malignità. Secondo criteri internazionalmente adottati, si riconoscono quattro gradi di malignità progressivamente crescente da I a IV. Ovviamente questa gradazione è schematica, potendosi riconoscere infinite sfumature tra un grado e l'altro (v. Kernohan e Sayre, 1952; v. Russel e Rubinstein, 1963; v. Zülch, 1979 e 1980). Biologicamente un tumore è tanto più maligno quanto più immature o indifferenziate sono le sue cellule costitutive; inoltre, il tumore benigno è separabile dai tessuti sani, quello maligno tende a infiltrarli. Considerando il grado di malignità con questi criteri, si calcola - sempre schematicamente - che un tumore di grado I (benigno), se opportunamente trattato neurochirurgicamente, possa guarire completamente o comunque consentire una lunga sopravvivenza, di diversi anni (mai meno di 5 anni); un tumore di grado IV (maligno), anche se trattato chirurgicamente, comporta di solito una sopravvivenza breve, in media di 6-15 mesi. Questi sono dati medi; i singoli casi possono discostarsi di molto dalla media. Così, ad esempio, non sono affatto eccezionali casi di portatori di tumore di grado IV, cioè maligno (per es. il germinoma), e soprattutto III (semimaligno) operati e poi sottoposti a radioterapia e chemioterapia, che sopravvivono molti anni; d'altra parte vi sono anche casi di tumori benigni o di grado I (per es. meningiomi o neurinomi endocranici) che pongono difficoltà insormontabili alla rimozione chirurgica completa per particolari condizioni locali e che portano a morte il paziente. Ciò significa che nella valutazione prognostica di un paziente portatore di un tumore endocranico o endorachideo occorre tener conto, oltre che delle caratteristiche biologiche del tumore, di molti altri elementi, i più importanti tra i quali sono: la posizione del tumore e suoi rapporti con le strutture circostanti; le dimensioni del tumore; la durata, l'entità e il tipo dell'alterazione neurologica già causata dal tumore; l'età e le condizioni generali del paziente.
Clinicamente la presenza di un tumore endocranico si rivela attraverso due tipi di sintomi: sintomi a focolaio, o locali, e sindrome di ipertensione endocranica. I primi sono dovuti al danno direttamente causato dal tumore su quella parte del cervello o di nervi encefalici dai quali origina o sui quali preme dall'esterno. Essi possono essere di natura irritativa, e quindi tradursi in epilessie di tipo focale, se è il cervello a essere interessato, e in parestesie, dolori o spasmi, se sono interessati i nervi encefalici. Oppure possono essere di natura deficitaria, e quindi tradursi in menomazioni funzionali (paralisi, alterazioni delle funzioni sensitive e sensoriali, o del linguaggio, o del comportamento ecc.). Tra i sintomi da danno locale vanno ricordati anche quelli dovuti al coinvolgimento dell'ipofisi e dell'asse ipotalamo-ipofisario, per tumori della regione sellare (ad es. adenomi ipofisari, craniofaringiomi) che determinano alterazioni della funzione endocrina ipofisaria e del metabolismo, spesso associate tipicamente ad alterazioni della funzione visiva per compressione delle vicine vie ottiche (v. Kohler e Ross, 1973; v. Maira e altri, 1980). L'aumento della pressione endocranica - che si manifesta con la tipica triade sintomatologica: cefalea, nausea o vomito e stasi della papilla ottica - può essere dovuto: 1) alle dimensioni cospicue della massa tumorale; 2) all'edema del tessuto cerebrale circostante; 3) all'ostacolo che il tumore rappresenta per il circolo liquorale e quindi allo sviluppo di idrocefalo (v. sotto, § f).
Il tumore endorachideo porta alla sindrome di compressione midollare: dolore locale, graduale diminuzione della motilità, parallelo aumento del tono muscolare (spasticità) e perdita della sensibilità nelle parti del corpo al di sotto del livello midollare compresso. Tumori molto lateralizzati possono premere sulle radici spinali e dare disturbi motori o sensitivi nei miomeri e nei dermatomeri corrispondenti. Tumori che si sviluppano all'interno del midollo, infine, causano, oltre alla sintomatologia sopra riportata, un segno clinico particolare: una ipoestesia bilaterale che interessa la sola sensibilità termodolorifica e i soli dermatomeri corrispondenti ai livelli midollari interessati (alterazione sensitiva detta di tipo siringomielico, in quanto tipica di questa malformazione midollare).
La diagnosi strumentale della patologia tumorale endocranica ed endorachidea utilizza praticamente tutti i mezzi descritti nel cap. 4. La TAC, tuttavia, è senza dubbio l'esame di prima scelta per i tumori endocranici; gli altri esami integreranno le informazioni TAC a seconda del tipo del tumore. Per i tumori endorachidei la mielografia rimane ancora l'esame più utile.
Come la prognosi, anche la corretta indicazione del trattamento chirurgico si basa sull'analisi accurata delle caratteristiche morfologiche, volumetriche e topografiche del tumore, del quadro neurologico e delle condizioni generali del paziente. I risultati chirurgici possono essere molto soddisfacenti. Si è arrivati oggi non solo a un consistente aumento della durata della vita, ma anche a un netto miglioramento della sua qualità. Si è raggiunto, inoltre, un considerevole allargamento delle indicazioni all'intervento chirurgico. È oggi possibile, infatti, operare con una netta riduzione della mortalità operatoria e con successo clinico tumori endocranici ed endorachidei fino a pochi anni fa ritenuti praticamente intoccabili. Come già ricordato, questi progressi dipendono in uguale misura dal raffinamento dei mezzi diagnostici e da quello dei mezzi chirurgici, che hanno portato rispettivamente a una identificazione molto più precoce della presenza del tumore e delle sue caratteristiche morfologiche e spaziali e a una riduzione del trauma chirurgico unita all'aumento della precisione.
Nel caso di tumori benigni e semibenigni (grado I e II), il trattamento chirurgico rappresenta il solo mezzo efficace oggi a disposizione: il tumore può essere rimosso completamente determinando una definitiva guarigione, oppure può essere ridotto considerevolmente di volume, consentendo al paziente di stare bene per lungo tempo in completa autonomia e, eventualmente, di essere rioperato dopo anni. Nel caso di tumori maligni e semimaligni (gradi IV e III) la neurochirurgia da sola può non essere sufficiente; è certamente possibile ottenere un sostanziale miglioramento delle condizioni neurologiche, ma, anche se asportato in modo apparentemente totale, il tumore tende a recidivare e, se di alta malignità, in tempi brevi. Come già accennato, in questi casi si affiancano alla neurochirurgia - di solito dopo il trattamento neurochirurgico - la radioterapia locale e la chemioterapia, analogamente a quanto si fa per i tumori maligni di altre parti del corpo. Per quanto attiene alla radioterapia dei tumori cerebrali (v. Sheline, 1977), si sono sviluppate di recente, in sostituzione o a completamento del trattamento radiante percutaneo: 1) la metodologia dell'infissione di sostanze emittenti radiazioni direttamente nel tumore (radioterapia interstiziale o curieterapia; v. Szikla, 1979; v. Scerrati e altri, 1982); 2) la metodologia che si basa su di un'unica somministrazione di energia radiante concentrata sul tumore, anche profondo, con il rispetto dei tessuti cerebrali circostanti (la cosiddetta radiochirurgia; v. Backlund, 1979). Ciò è stato reso possibile dalla tecnica stereotassica (v. cap. 5), che appunto consente questa infissione di particelle radioattive con un minimo trauma e con la massima precisione, elementi assolutamente necessari per conseguire l'effetto voluto e non produrre danni da radiazioni al parenchima cerebrale peritumorale. I risultati sono buoni. Meno buoni, al momento, i risultati della chemioterapia, che, peraltro, è un mezzo di trattamento di estremo interesse e potenzialità e che, quindi, costituisce un campo di ricerca assai attiva e promettente (v. Hildebrand e Brihaye, 1978; v. Wilson e altri, 1982; v. chemioterapia antineoplastica).
A conclusione di questo capitolo sui tumori, sembra opportuno ricordare brevemente una particolare condizione definita come pseudotumor cerebri (v. Zuidema e Cohen, 1954). Nonostante che il quadro clinico sia quello di una ipertensione endocranica, non vi sono tumori endocranici né idrocefalia. La malattia colpisce soprattutto il sesso femminile, in età feconda. Gli esami neuroradiologici, e in particolare la TAC, mostrano l'immagine di un cervello rigonfio. L'eziopatogenesi non è nota; si ritiene possibile l'intervento di fattori endocrino-metabolici. Esclusa la presenza di un tumore e di un idrocefalo, il trattamento è medico, basato su farmaci antiedema.
e) Infezioni e parassitosi.
Le infezioni cranio-encefaliche e vertebro-midollari che interessano la neurochirurgia sono soprattutto quelle batteriche. Diversi tipi di batteri possono essere in causa. Le modalità più comuni di infezione del cranio o dei suoi contenuti sono: 1) dall'esterno, nel caso di ferite aperte (comprese quelle chirurgiche!); 2) da estensione di processi infettivi della regione otomastoidea o sinusale; 3) da diffusione per via ematica da focolai infettivi situati altrove (v. Brewer e altri, 1975; v. Van Alphen e Dreissen, 1976; v. Goodman e Stern, 1982). Le infezioni vertebro-midollari, più rare, hanno soprattutto origine ematogena (v. Wright, 1982).
L'infezione può interessare isolatamente le parti ossee (osteomielite), le meningi (meningite ed empiema periencefalico), le arterie (arteriti) e, soprattutto, le vene (fiebiti e tromboflebiti), il cervello (encefaliti e ascesso cerebrale) o il midollo (mielite e ascesso midollare), o più di una di queste strutture contemporaneamente. Le manifestazioni cliniche comprendono: segni generali di infezione; segni di irritazione meningea; segni di danno locale, variabili a seconda della sede dell'infezione. Cospicue raccolte purulente endocraniche (come gli ascessi) portano all'ipertensione endocranica. La diagnosi è clinica e neuroradiologica.
Il trattamento chirurgico viene considerato quando fallisce quello antibiotico. Le finalità del trattamento sono, a seconda delle caratteristiche del processo infettivo: l'asportazione del tessuto infetto (per es. zone di volta cranica colpite da osteomielite); il drenaggio esterno di raccolta purulenta, con lavaggio locale mediante soluzioni antibiotiche (per es. empiema sottodurale o epidurale o ascesso endocranico o endorachideo); l'asportazione in toto di masse ascessuali (cerebrali o, più raramente, midollari). La correzione di deformazioni vertebrali da infezione (per es. morbo di Pott) è in genere eseguita dall'ortopedico.
Attualmente molto rare, le localizzazioni di parassiti al cranio-encefalo e al rachide-midollo si riscontrano soprattutto in alcune aree geografiche a scarso sviluppo. Le più comuni sono la cisticercosi (larva di Taenia solium, forma cistica e forma racemosa) e la idatidosi (larva di Taenia echinococcus, forma cistica). La sintomatologia clinica include varie manifestazioni, che vanno dall'irritazione meningea all'ipertensione endocranica o alla compressione midollare. La neurochirurgia mira all'asportazione della cisti parassitaria, avendo cura di evitarne la rottura, che produrrebbe una diffusione del parassita. Si tratta spesso di patologia assai grave che, se non curata, può portare a morte il paziente (v. Araila-Iniguez, 1973).
f) Idrocefalo e alterazioni della circolazione liquorale.
L'abnorme accumulo del liquido cerebro-spinale, o liquor, in ogni spazio liquorale endocranico costituisce idrocefalo (v. Brock e Dietz, 1972; v. Lundberg e altri, 1975; v. Beks e altri, 1976; v. Shulman e altri, 1980; v. Shapiro e altri, 1984). In pratica, tuttavia, il termine viene usato per indicare l'eccesso di liquor nel sistema ventricolare, che quindi si dilata abnormemente. Normalmente il liquor viene prodotto dai plessi conoidei, i maggiori dei quali si trovano nei ventricoli laterali; dai ventricoli laterali esso passa prima nel III, poi nel IV ventricolo, quindi esce dal sistema ventricolare e penetra negli spazi cisternali o subaracnoidei endocranici ed endorachidei; lungo questi spazi risale verso la volta cranica e qui, attraverso le granulazioni del Pacchioni, viene assorbito e immesso nella circolazione venosa. I meccanismi fondamentali dell'idrocefalo sono tre: aumento della produzione del liquor, ostacolo alla sua circolazione all'interno del sistema ventricolare, o di quello cisternale, e riduzione del suo assorbimento. Il primo meccanismo è assai raro e si riscontra in alcuni tumori dei plessi conoidei. Gli altri due meccanismi sono invece entrambi di frequente evenienza. L'ostacolo alla circolazione (il secondo meccanismo) può instaurarsi a qualsiasi livello del sistema liquorale, ma soprattutto a livello delle sue strozzature. Come già ricordato, la natura dell'ostacolo è molteplice: malformativa, tumorale, infettiva, ecc. Il difetto di assorbimento (il terzo meccanismo) è di solito dovuto a sderotizzazione delle granulazioni del Pacchioni come esito di infezioni (meningiti) o di emorragie subaracnoidee della convessità cerebrale (da rottura di aneurisma o da trauma).
Indipendentemente dalla sua eziopatogenesi, l'accumulo del liquor all'interno dei ventricoli determina una loro abnorme dilatazione e un aumento della pressione all'interno del cranio. Di conseguenza, clinicamente, l'idrocefalo si manifesta con una sindrome di ipertensione endocranica (v. sopra, È d), a evoluzione più o meno rapida e di entità più o meno accentuata a seconda delle cause. La dilatazione ventricolare è messa bene in evidenza dalla TAC, dalla ventricolografia e anche dall'ecografia. Nell'idrocefalo congenito o del neonato (dovuto soprattutto a patologie malformative; v. O'Brien, 1982), oltre ai segni cimici dell'ipertensione cranica, vi è il tipico e inconfondibile aumento del volume cranico, con abnorme tensione delle fontanelle.
Il trattamento del paziente idrocefalico è solamente chirurgico. Là dove possibile, esso è causale, cioè mira a rimuovere la patologia che è responsabile dell'idrocefalo (per es. asportando un tumore o correggendo una malformazione che crea ostacolo al circolo liquorale). Altrimenti, esso mira a creare al liquor che non può più circolare o che non può più essere assorbito una via di circolazione o di assorbimento alternativa. Ciò si ottiene con le cosiddette derivazioni liquorali, di cui le più usate sono le derivazioni esterne (ventricolo-peritoneali o ventricolo-atriali; v. Nulsen e Spitz, 1971). L'intervento, come già ricordato, consiste nel connettere il sistema ventricolare cerebrale con la cavità peritoneale o con l'atrio destro cardiaco (dove vi è una pressione minore che a livello ventricolare) mediante un sistema di cateteri con inserita una valvola unidirezionale che si apre alla pressione voluta; in tal modo il liquor viene assorbito dalla sierosa peritoneale o immesso nel circolo ematico. Queste derivazioni protesiche sono ben tollerate dall'organismo e possono essere mantenute per tutta la vita. Alternativamente, e limitatamente all'idrocefalo da ostacolo alla circolazione liquorale con normale assorbimento, è possibile saltare (by-pass) l'ostacolo stesso, creando una comunicazione artificiale tra i settori ventricolari o tra ventricoli e cisterne a monte e a valle dell'ostacolo (derivazioni interne, come ad es. la ventricolo-cisternostomia).
Una forma particolare è quella del cosiddetto idrocefalo normoteso, descritta per la prima volta da Hakim e Adams (v., 1965). Essa ha in comune con quella sopra descritta la dilatazione ventricolare, ma la pressione endocranica, considerata in condizioni di base, è contenuta entro limiti fisiologici. Per quanto non del tutto chiarito, il principale meccanismo responsabile sembra essere quello di un parziale difetto del riassorbimento del liquor, in parte compensato da assorbimento transependimale. Quest'ultimo può essere messo in evidenza con la TAC e l'inversione del circolo liquorale che ne è alla base (il liquor, invece di defluire dai ventricoli verso le cisterne, sale dalle cisterne verso i ventricoli) è documentabile con la cisternoscintigrafia isotopica. In realtà la pressione endocranica è normale solamente se la si misura in condizioni di base (paziente a riposo) e come pressione media. Essa, tuttavia, mostra elevazioni abnormi in condizioni particolari, quale ad esempio la cosiddetta fase REM del sonno, e abnorme ampiezza delle oscillazioni pressorie endocraniche sincrone con il polso arterioso (v. Di Rocco e altri, 1976; v. Rossi e altri, 1975 e 1977). Si tratterebbe, cioè, di un idrocefalo ‛saltuariamente iperteso'. Esso può svilupparsi qualche tempo dopo un'emorragia subaracnoidea, o un trauma cranico, in non pochi casi senza alcun evidente precedente. Nella grande maggioranza dei casi, questa particolare forma di idrocefalia colpisce soggetti adulti. Tipiche sono le sue manifestazioni cliniche, costituite da: progressivo decadimento psichico di tipo demenziale; disturbo dell'andatura di tipo atassico, spesso associato a segni piramidali; perdita del controllo degli sfinteri. In certi casi può essere difficile la diagnosi differenziale con forme di atrofia cerebrale presenile. Nei casi tipici di idrocefalo normoteso il trattamento chirurgico porta a risultati ottimi; esso consiste in una derivazione liquorale ventricolo-peritoneale o ventricolo-atriale.
Una forma morbosa particolare, non assimilabile all'idrocefalo, ma avente probabilmente in comune con esso un disordine della circolazione liquorale, è la cosiddetta ‛sella vuota' (v. Berke e altri, 1975; v. Jordan e altri, 1977), che colpisce quasi esclusivamente il sesso femminile. Anatomicamente essa consiste nella estroflessione degli spazi liquorali subaracnoidei (diverticolo aracnoideo) all'interno della sella turcica. Funzionalmente, e quindi clinicamente, si manifesta con un deficit della funzione dell'ipofisi o del peduncolo ipotalamo-ipofisario; ciò sembra essere la conseguenza dell'eccessiva pressione esercitata su questa struttura dal diverticolo aracnoideo di cui sopra (v. Maira e altri, 1984). L'origine di questo diverticolo è incerta. È interessante sottolineare che l'accurata valutazione della pressione liquorale in questi pazienti mostra valori abnormi. Risultati molto buoni sono stati ottenuti con derivazioni liquorali dai ventricoli (ventricolo-peritoneali o ventricoloatriali) o anche dallo spazio subaracnoideo lombare (spinoperitoneali), verosimilmente dovuti alla diminuzione della pressione esercitata dal diverticolo aracnoideo sull'ipofisi e sul suo peduncolo.
g) Alterazioni vascolari acquisite.
Le alterazioni vascolari, che si traducono in emorragie o ischemie, considerate nel loro complesso sono la più frequente causa di danno del sistema nervoso centrale, specie a livello cerebrale. La maggior parte dei pazienti colpiti da queste alterazioni non è suscettibile di trattamento neurochirurgico (si pensi, ad esempio, al grande campo dell'insufficienza circolatoria cerebrale da arteriosclerosi diffusa); questi casi non verranno qui considerati. Alcuni aspetti di questa patologia aventi interesse neurochirurgico (aneurismi, malformazioni artero-venose e inginocchiamenti delle arterie, ematomi cerebrali e pericerebrali traumatici) sono stati trattati già nei paragrafi sulle malformazioni vascolari e sui traumi. Verranno quindi qui considerate le più importanti, per frequenza e interesse clinico, delle rimanenti alterazioni vascolari, tutte acquisite, che richiedono il trattamento neurochirurgico o che comunque possono trarne vantaggio.
Le emorragie cosiddette ‛spontanee' del cervello o, molto più raramente, del midollo, di solito colpiscono soggetti in età adulta (v. Allen e altri, 1982). È verosimile che esse siano dovute al concorrere di fattori diversi, in particolare l'ipertensione arteriosa e alterazioni regressive della parete delle arteriole; non è da escludersi la possibile esistenza di micromalformazioni, non rilevabili con i mezzi diagnostici e neppure all'autopsia. La sintomatologia clinica dell'emorragia cerebrale è di tipo apoplettiforme: improvvisamente il paziente avverte violenta cefalea e quindi perde coscienza (ictus apoplettico o emorragico). Possono concomitare gravi alterazioni vegetative. Se il coma non è profondo, si mettono in evidenza segni neurologici focali, in rapporto alla sede dell'emorragia. Se il paziente sopravvive alla fase acuta, può svilupparsi una sindrome di ipertensione endocranica dovuta alla combinazione dell'effetto massa esercitato dal sangue con l'inevitabile edema cerebrale circostante. Quando il sangue stravasato è raccolto a formare una massa compatta - l'ematoma - può essere asportato neurochirurgicamente. La TAC è l'esame più indicato per mettere in evidenza presenza e caratteristiche dell'emorragia. Meno frequenti di quelle cerebrali sono le emorragie midollari (ematomielia): clinicamente, salvo che per l'esordio di solito acuto, esse hanno aspetto simile a quello dei tumori intramidollari (v. sopra, § d).
Ematomi pericerebrali e perimidollari spontanei, cioè raccolte ematiche cospicue tra superficie esterna del cervello e del midollo e superficie interna del cranio e del canale rachideo, si riscontrano nell'età adulta o nell'anziano. Se raggiungono dimensioni cospicue, la compressione che essi esercitano sul cervello o sul midollo porta rispettivamente a segni neurologici di ipertensione endocranica e a focolaio, e di compressione midollare. La diagnosi è semplice con la TAC o con l'angiografia. L'evacuazione chirurgica è in genere risolutiva.
L'ischemia, o insufficienza circolatoria, come l'emorragia è molto più frequente a carico del cervello che del midollo e, comunque, solo molto raramente l'ischemia midollare è suscettibile di trattamento neurochirurgico. L'ostacolo al passaggio del sangue diretto al cervello può situarsi a livello sia cervicale (arterie carotidi o vertebrali) sia endocranico (diramazioni delle stesse arterie carotidi o vertebrali). Può trattarsi di un'embolia o di una trombosi o di una compressione del vaso dall'esterno. Nella maggior parte dei casi questo ostacolo è conseguenza di processi degenerativi della parete arteriosa, di tipo aterosclerotico, soprattutto delle arterie carotidi. Come l'emorragia, anche l'ischemia cerebrale insorge in genere in modo rapido. A seconda del calibro dell'arteria ostruita e della possibilità di circoli vicarianti o di compenso, la sintomatologia va dal coma a segni neurologici a focolaio, questi ultimi in rapporto alle proprietà funzionali del territorio cerebrale privato del suo normale apporto ematico. L'ostacolo al circolo può essere rapidamente reversibile (per es. lisi di un piccolo embolo o trombo) oppure rapidamente compensato dalla circolazione collaterale; di conseguenza, la sintomatologia clinica è transitoria (attacchi ischemici reversibili o transitori). Oppure l'ostacolo è definitivo o permane per lungo tempo e il circolo collaterale non è sufficiente; di conseguenza, si verifica un infarto cerebrale e la sintomatologia clinica è permanente (ictus cerebrale ischemico stabilizzato). È statisticamente dimostrato che un paziente che ha subito un attacco ischemico transitorio con facilità ne subirà un altro e, ciò che è assai più grave, è particolarmente esposto a subire un ictus definitivo.
Molti dei mezzi ricordati nel cap. 4 devono essere messi in opera per un inquadramento diagnostico corretto del paziente con ischemia cerebrale. Tra i più importanti ricordiamo: la TAC, l'angiografia, lo studio del flusso ematico cerebrale (v. tav. I,1 e 3), lo studio elettrofisiologico dell'attività neuronale, oltre che, naturalmente, un accurato studio clinico. Dal punto di vista del trattamento, la neurochirurgia si pone due finalità principali: 1) nel paziente che ha avuto un attacco ischemico transitorio: prevenire altri attacchi e, soprattutto, prevenire la comparsa di un ictus stabilizzato; 2) nel paziente che ha avuto un ictus: in fase acuta, ripristinare il circolo così rapidamente da impedire la morte dei neuroni cerebrali (l'infarto); in fase cronica (ictus stabilizzato), prevenire un secondo ictus (evenienza tutt'altro che rara) e migliorare le condizioni neurologiche attraverso il miglioramento dell'irrorazione ematica e quindi del funzionamento dei neuroni cerebrali sofferenti, ma ancora viventi, circostanti al focolaio infartuale. La più semplice delle modalità chirurgiche per conseguire questi scopi è la rimozione dell'ostacolo al circolo; ciò è relativamente facile se l'ostacolo è a carico delle grandi arterie, come le carotidi o le vertebrali (v. Bauer e altri, 1969; v. Blaisdell e altri, 1969; v. Fields e altri, 1970; v. Robertson e Auer, 1982), più difficile se esso si situa a livello delle loro diramazioni intracraniche, ma comunque possibile con l'uso del microscopio operatorio. La modalità chirurgica alternativa è quella di scavalcare l'ostacolo (by-pass) creando una nuova via al flusso ematico; le più diffuse metodologie per conseguire questo scopo sono: 1) la congiunzione, mediante inserimento di un segmento di vaso artificiale, del tratto di arteria sotto o a monte dell'ostacolo con il tratto della stessa arteria situato sopra o a valle: questa tecnica si attua di frequente quando l'ostacolo non asportabile si trova a livello dei grossi vasi (specie le arterie carotidi al collo); 2) la congiunzione di un'arteria del circolo extracranico con un'arteria del circolo cerebrale situata a valle dell'ostacolo, attraverso un'apertura cranica e meningea adeguatamente preparata (anastomosi arteriosa extra-intracranica: v. tav. I,4); 3) la trasposizione sulla superficie cerebrale ischemica, esposta adeguatamente, di muscolo temporale con la sua naturale vascolarizzazione o di omento vascolarizzato dalla carotide esterna mediante opportuno intervento di anastomosi vascolari; anastomosi naturali si creano tra i piccoli vasi del muscolo o dell'omento e quelli ischemici del cervello. Le tecniche 2 e 3 sono attuabili sia nel caso di ostacolo a livello dei grossi vasi (carotidi e vertebrali) sia in quello di ostacolo delle più piccole arterie intracraniche. Da sottolineare, ancora una volta, come il microscopio operatorio sia indispensabile per realizzare queste anastomosi tra arterie, spesso interessanti arterie del calibro di uno-due millimetri (v. Donaghy e Yasargil, 1971; v. Austin, 1976; v. Fein e Reichman, 1978; v. Rossi e Maira, 1981; v. chirurgia: Microchirurgia ricostruttiva, suppl.).
I risultati del trattamento chirurgico sono molto incoraggianti per quanto riguarda la possibilità di migliorare le condizioni neurologiche nell'ictus stabilizzato, a condizione che i pazienti siano selezionati con cura (v. Rossi e Maira, 1981); sono per ora deludenti nell'ictus in fase acuta, forse perché l'intervento dovrebbe, per impedire la morte neuronale, essere ultimato entro tempi così brevi (4 ore dall'ictus) da renderlo praticamente inattuabile; sono ancora incerti per quanto riguarda la possibilità di proteggere un cervello che ha già subito attacchi ischemici - transitori o permanenti - da attacchi successivi.
h) Alterazioni degenerative del rachide.
È questo un settore della patologia che, pur comprendendo lesioni del sistema nervoso che si manifestano con sintomatologia neurologica, viene sovente trattato, oltre che dai neurochirurghi, anche dagli ortopedici. Ciò è dovuto al fatto che si tratta di una patologia che interessa primitivamente le strutture osteo-articolari, più precisamente i corpi vertebrali e i dischi intervertebrali (v. Rothman e Simeone, 1975).
Se, per fenomeni di tipo degenerativo che si manifestano soprattutto nel pieno dell'età adulta, l'anulo fibroso del disco intervertebrale si indebolisce, può rompersi; la rottura è spesso favorita da accentuate sollecitazioni dell'articolazione; il nucleo polposo del disco viene parzialmente espulso (ernia del disco) e va a comprimere le strutture nervose contenute entro il canale rachideo, più spesso le radici (ernie laterali), più raramente il midollo (ernie mediane). Per ragioni meccaniche i livelli preferenziali del rachide in corrispondenza dei quali si verificano le ernie sono quello lombo-sacrale e quello cervicale. Se sono le radici a essere compresse, l'ernia discale si manifesta con vivo dolore nel territorio corrispondente (sciatalgia, cervico-brachialgia), che può associarsi a paresi di alcuni muscoli; se è compresso il midollo, si hanno i sintomi della compressione midollare (v. sopra, § d). La diagnosi si basa sull'integrazione della clinica con la mielografia (o sacculoradicolografia per le ernie lombo-sacrali) e in alcuni casi l'elettromiografia. L'asportazione chirurgica dell'ernia risolve il problema.
Il processo degenerativo può portare alla formazione di osteofiti che protrudono all'interno del rachide e possono comprimere midollo e radici. Questi osteofiti si associano di frequente a protrusioni discali. Il fenomeno quando si sviluppa a livello cervicale, è causa della cosiddetta mielopatia o mieloradiculopatia da spondiloartrosi (v. Smith, 1968; v. Braakman, 1979). La compressione su midollo e radici è favorita dai continui movimenti della colonna cervicale. Conseguenza clinica sono dolori locali e agli arti superiori e, soprattutto, paresi spastica agli arti inferiori, tutti con insorgenza subdola e progressione lenta. La mielopatia e la mieloradiculopatia spondiloartrosica sono molto comuni nella tarda età adulta, specie nei maschi. Anche per questi pazienti il mezzo diagnostico principale è la mielografia, integrata con l'esame clinico e radiografico del rachide; utile la TAC e, soprattutto, la mielo-TAC. L'intervento chirurgico ha lo scopo di eliminare o alleggerire la compressione midollare e radicolare. A tal fine si possono asportare gli osteofiti (e il disco), allargare il canale rachideo e saldare (fusione) i corpi vertebrali tra loro onde ridurne i movimenti.
i) Epilessie parziali.
Sono definite epilessie parziali quelle epilessie dovute ad alterazione dell'eccitabilità dei neuroni di zone circoscritte del cervello. Da queste zone cerebrali, definite zone epilettogene (il focus della vecchia terminologia), partono le scariche di impulsi che, arrivando alla periferia, danno luogo alle manifestazioni cliniche della crisi epilettica. Queste manifestazioni possono quindi essere di vario tipo, più o meno semplici o complesse, in rapporto appunto alla caratterizzazione funzionale del settore cerebrale interessato: motorio, sensitivo, visivo, acustico, viscerale, con contenuti emozionali o psichici, ecc. Di frequente la scarica epilettica può propagarsi dalla sua zona di origine ad altri distretti cerebrali e anche a tutto il cervello (generalizzazione), in tal modo aggravando considerevolmente le manifestazioni critiche. Come già si è visto in alcuni dei capitoli precedenti, l'epilettizzazione neuronale può essere dovuta alle patologie endocraniche più varie: alterazioni circolatorie, cicatrici postinfettive e post-traumatiche sono le più frequenti e inoltre malformazioni e tumori (v. Penfield e Jasper, 1954; v. Magnus e Lorentz de Haas, 1974).
Lo studio diagnostico del paziente con epilessia parziale tende a scoprire la patologia causale dell'epilessia stessa e la localizzazione dei neuroni cerebrali che sono divenuti epilettici in conseguenza di questa patologia e che formano la zona epilettogena. A tal fine si utilizzano mezzi diagnostici radiologici (la TAC è oggi il più usato) ed elettrofisiologici (l'elettroencefalografia). L'insieme della patologia causale e della zona epilettogena costituisce il ‛complesso lesionale funzionale epilettogeno' (v. Rossi e altri, 1974).
Nei casi in cui l'epilessia è dovuta a una patologia endocranica di natura tale da richiedere di per sé un trattamento particolare, medico o chirurgico (per es. insufficienza circolatoria, infezione, tumore, malformazione), il paziente non viene diagnosticato come epilettico, ma conformemente alla patologia di base. Quando, viceversa, la patologia endocranica causale non richiede di per sé un trattamento particolare (come ad esempio nel caso di una cicatrice meningocerebrale) è l'epilessia che ne consegue che diventa il solo oggetto del trattamento e il paziente viene diagnosticato come epilettico. Sono questi ultimi i pazienti considerati nel presente paragrafo. Si stima oggi che, nella maggior parte di questi pazienti (circa l'8o%), i farmaci antiepilettici siano sufficienti a controllare le crisi. Per i rimanenti casi, e specialmente quando le crisi sono tali, per numero e gravità, da impedire l'inserimento del paziente nella vita sociale o scolastica o anche familiare, può essere preso in considerazione il trattamento neurochirurgico.
Lo scopo del trattamento chirurgico è duplice: asportazione del ‛complesso epilettogeno', cioè della patologia causale (per es. la cicatrice) e della zona epilettogena. È evidente che la precisa definizione diagnostica sia della patologia causale sia della zona epilettogena è indispensabile per il neurochirurgo. Ecco perché ai mezzi diagnostici tradizionali sopra ricordati la neurochirurgia affianca altri mezzi peculiari, tra cui soprattutto quelli basati sulla registrazione dell'attività elettrica cerebrale direttamente dal cervello (v. cap. 4, § d; tav. IV,2). Infatti con indagini diagnostiche quali l'elettrocorticografia (ECOG) e la stereoelettroencefalografia (SEEG), accuratamente correlate con le manifestazioni cliniche delle crisi, si possono ottenere informazioni molto precise e dettagliate (v. Bancaud e Talairach, 1965; v. Rossi e altri, 1974, 1982 e La registrazione..., 1984). Nei casi bene diagnosticati i risultati dell'intervento chirurgico sono ottimi, con scomparsa definitiva delle crisi.
In alternativa al tipo di approccio di cui sopra, da considerarsi indubbiamente il più efficace, la neurochirurgia offre altre due modalità di trattamento. La prima, anziché asportare il ‛complesso epilettogeno', interrompe le vie principali di propagazione delle scariche epilettiche che da esso nascono; la seconda tende a ridurre l'eccitabilità neuronale cerebrale esaltando artificialmente meccanismi a funzione inibitoria (v. Ojemann e Ward, 1975; v. Gillingham e altri, 1980; v. Gybels e altri, 1984). Esempio del primo approccio è la sezione del corpo calloso, del secondo la stimolazione elettrica del cervelletto (v. Cooper e altri, Chronie cerebellar stimulation in epilepsy, 1976). Entrambe queste modalità chirurgiche non pretendono di sopprimere l'epilessia, ma di diminuirne la gravità. Esse quindi possono essere prese in considerazione quando la metodologia neurochirurgica più efficace, prima descritta, non è attuabile (per es. complessi epilettogeni multipli o interessanti zone cerebrali che non si possono rimuovere, quale quella del linguaggio).
l) Dolori cronici.
Il dolore è uno dei sintomi più comuni delle più diverse patologie di ogni parte del corpo: sintomo utile, in quanto segnala la presenza e la sede di un processo morboso. In genere, guarita l'affezione di base, il dolore scompare. Vi sono pazienti, tuttavia, per i quali il dolore diviene il problema medico principale e, quindi, l'oggetto stesso della terapia: ad esempio, quando la malattia di base non è curabile (come nei dolori da cancro avanzato: v. neoplasie: Dolore e terapia del dolore, suppl.) o non è nota (come in certe cefalee e nevralgie). In molti di questi casi i farmaci antidolorifici riescono a contenere il dolore; in altri ciò non accade oppure si è costretti a ricorrere a farmaci pericolosi, quali gli oppiacei. Sono questi i casi in cui, se il dolore è intenso e dura a lungo (dolori cronici), si cerca il soccorso della neurochirurgia (v. Bonica, 1953; v. Noordenbos, 1959; v. White e Sweet, 1969; v. Gillingham e altri, 1980; v. Siegfried e Hood, 1983; v. Gybels e altri, 1984).
La più ovvia, e la più antica, modalità neurochirurgica di trattamento del dolore consiste nell'interruzione della via nervosa che porta gli impulsi dolorifici dalla loro sede di origine ai centri superiori. Questa interruzione può essere praticata a quasi tutti i livelli della via della sensibilità dolorifica, dalla periferia ai centri talamici. Alternativamente, o in aggiunta a quanto sopra, possono essere chirurgicamente distrutti vie o centri nervosi a funzione integrativa, specie a livello del talamo non specifico, responsabili della tipica connotazione spiacevole della sensibilità dolorifica. Oppure, infine, il neurochirurgo può agire sui nuclei talamici anteriori, in connessione con le regioni prefrontali, e interferire con la componente psichica del dolore (il paziente avverte ancora il dolore, ma non ne soffre: in realtà questo è un intervento di psicochirurgia). Tranne che per quest'ultima, oggi assai poco utilizzata, queste modalità chirurgiche demolitive sono impiegate con successo nella maggior parte dei dolori cosiddetti somatogenici (v. Gybels, 1984), cioè dovuti a stimolazione o irritazione delle vie dolorifiche da parte del processo morboso. La scelta del livello dell'intervento lungo la via della sensibilità dolorifica dipende dalla sede del dolore. L'intervento può essere eseguito con mezzi chirurgici tradizionali, o con l'iniezione locale di sostanze chimiche o, come oggi si usa molto più di frequente (a livello midollare e soprattutto cerebrale), con approccio stereotassico. L'interruzione della via della sensibilità dolorifica porta alla soppressione del dolore, ma causa inevitabilmente un'anestesia che può coinvolgere altre sensibilità, specie quella termica, associata a quella dolorifica. Ciò può essere fastidioso per il paziente. Di recente si è constatato che, quanto meno in certe forme di dolore (come ad esempio nella nevralgia del trigemino; v. Sweet e Wepsic, 1974; v. Jannetta, 1976; v. Mullan e Lichtor, 1983), è sufficiente praticare manipolazioni delle strutture nervose sensitive di minima entità, tali da non distruggerle e, quindi, da non causare anestesia, pur ottenendo un efficace risultato sul dolore.
Un mezzo alternativo a quello demolitivo, per il trattamento del dolore somatogenico, è la somministrazione di fenolo o ancora meglio di morfina a dosi piccolissime, tali da non dare assuefazione, per via endorachidea (v. Lazorthes e altri, 1980). Ciò è attuabile collocando un piccolo catetere nello spazio endorachideo, peridurale o sottodurale, e collegandolo con un sistema particolare che consente la somministrazione del farmaco a intervalli regolari per tempi molto lunghi (anche mesi). È un mezzo terapeutico non demolitivo, molto utile nei dolori da cancro della pelvi.
Vi sono dolori che non sono dovuti all'irritazione delle vie della sensibilità dolorifica ma, al contrario, si sviluppano dopo il danno provocato alla via dolorifica dalla malattia. Ciò può verificarsi a livello periferico, e ne è tipico esempio il dolore vivissimo che l'amputato può avvertire nella gamba che non ha più (arto fantasma doloroso), oppure a livello cerebrale, e ne è esempio il dolore, sovente insopportabile, a tutto o a parte di un emicorpo per lesione del talamo controlaterale, in genere di origine circolatoria (sindrome talamica). È questo il dolore detto neurogenico o da deafferentazione (v. Gybels, 1984). Quasi sempre inutili sono i tentativi di controllarlo con i mezzi chirurgici sopra ricordati. Ciò ha portato a sviluppare mezzi chirurgici non demolitivi che, attraverso stimolazione elettrica, mettono in azione meccanismi neurofisiologici o neurochimici capaci di ridurre la trasmissione del dolore (neurostimolazione; neurochirurgia aumentativa). Come gli interventi demolitivi, anche quelli di stimolazione possono essere eseguiti a diversi livelli del nevrasse, dalla periferia al talamo. Il meccanismo neurofisiologico di controllo del dolore viene esaltato portando la stimolazione su strutture implicate nella trasmissione e nell'elaborazione della sensibilità tattile propriocettiva; il meccanismo neurochimico, forse consistente in una liberazione di endorfina, è attivato dalla stimolazione di strutture grigie centrali para-terzoventricolari o para-acqueduttali. Gli elettrodi stimolanti vengono introdotti ai livelli desiderati o manualmente sotto controllo radiologico (per es. per la stimolazione delle colonne dorsali del midollo, o del ganglio di Gasser; v. Meyerson e Håkansson, 1980; v. Siegfried e Hood, 1983; v. Meglio, 1984), o con metodo stereotassico (per es. per la stimolazione del talamo; v. Sweet, 1982); gli elettrodi vengono poi direttamente connessi o con il generatore di impulsi oppure con un'antenna ricevente, entrambi applicabili nel tessuto sottocutaneo. Il paziente, opportunamente istruito, esegue autonomamente la stimolazione, con un ritmo prestabilito. Il trattamento può essere protratto per anni e i risultati sono assai soddisfacenti.
m) Distonie e discinesie.
Lesioni del sistema nervoso centrale, cerebrali e midollari, che colpiscono nelle sue componenti extrapiramidali o Piramidali il complesso sistema regolatore della motilità e del tono posturale, sono ovviamente seguite da disordini di queste funzioni.
Per quanto riguarda il sistema extrapiramidale, vi sono malattie, di natura degenerativa o infettiva o circolatoria, nelle quali i disordini suddetti costituiscono l'aspetto clinico dominante e per le quali non vi è un trattamento causale efficace; il problema terapeutico si identifica quindi nel trattamento del conseguente disordine della motilità e del tono (v. l'analogia con quanto scritto sul trattamento di certe epilessie e del dolore cronico). I quadri sindromici più noti sono: il morbo di Parkinson, le coreo-atetosi, distonie muscolari di vario tipo ed entità (la più diffusa delle quali è il torcicollo spastico). Essi hanno in comune la coesistenza di un aumento del tono muscolare (distonia) e di movimenti involontari (discinesia). Come per le epilessie e per i dolori cronici, la terapia neurochirurgica è indicata se la terapia farmacologica fallisce. La neurochirurgia cerca di correggere sia la distonia sia la discinesia ribilanciando la funzione delle strutture extrapiramidali regolatrici di tono e movimento, sbilanciata dalla malattia. Ciò è possibile producendo piccole lesioni selettive di alcune di queste strutture a livello dei gangli della base o del talamo o del subtalamo. La metodologia stereotassica è indispensabile. I risultati migliori si ottengono nel morbo di Parkinson, con la scomparsa o una rilevante attenuazione sia del tipico tremore sia della distonia. Più difficile, invece, la correzione delle ipercinesie coreo-atetosiche e delle distonie tipo torcicollo (v. Cooper, 1969; v. Riechert, 1973; v. Gillingham e altri, 1980; v. Siegfried e Hood, 1983; v. Gybels e altri, 1984).
Un altro tipo di distonia, detto spasticità, segue alla lesione del sistema piramidale e si accompagna sempre alla riduzione o alla soppressione della Capacità motoria. I quadri clinici più noti sono: la spasticità agli arti inferiori per lesione piramidale bilaterale a livello del midollo spinale (paraparesi o paraplegia spastica); quella, interessante i quattro arti, da lesioni cerebrali complesse perinatali o neonatali; quella agli arti superiore e inferiore di un lato per lesione piramidale emisferica cerebrale (emiparesi o emiplegia spastica). Poco possono i farmaci per ridurre la spasticità. Molto utile è la fisioterapia, e talvolta anche la neurochirurgia (v. Cook e Weinstein, 1973; v. Gros, 1979; v. Siegfried e Hood, 1983). Le modalità chirurgiche prospettate per la spasticità da lesione midollare sono molte, ognuna tendente a valorizzare l'uno o l'altro aspetto dei complessi meccanismi centrali e periferici della regolazione del tono. Quelle oggi più usate, perché più efficaci, sono l'interruzione parziale delle radici spinali posteriori (radicellotomia) e la stimolazione elettrica delle colonne dorsali del midollo spinale (simile a quella usata per certi dolori). Per la spasticità da lesioni cerebrali infantili i risultati sono in complesso scarsi; interessanti i tentativi di lesione e soprattutto di stimolazione del cervelletto (v. i contributi di Cooper e altri, 1976). Per l'emiparesi spastica, infine, pochissimo è stato fatto, ma sono oggi in corso promettenti tentativi di neurostimolazione elettrica sia cerebrale sia midollare.
È opportuno chiudere questo capitolo sulle distonie e sulle discinesie con un cenno alle possibilità che la neurochirurgia offre nel trattamento della vescica neurologica, cioè delle disfunzioni vescicali conseguenti a gravi lesioni del midollo spinale (v. Rockswold e Chou, 1982). Ottimi risultati sono stati ottenuti con la stimolazione elettrica delle colonne dorsali del midollo spinale (v. Meglio e altri, 1980). Il miglioramento della funzione vescicale, in genere parallelo a quello concomitante della spasticità, è dovuto a una migliore coordinazione delle componenti muscolari e sfinteriali della vescica.
Bibliografia.
Allen, M. B., Yaghmai, F. Jr., Elgammal, T., Spontaneous intracerebral and intracerebellar hemorrhage, in Neurological surgery (a cura di J. R. Youmans), vol. III, Philadelphia 1982, pp. 1821-1849.
Araña-Iniguez, R., Hydatid echinococcosis of the nervous system, in Tropical neurology (a cura di J. D. Spillane), London 1973, pp. 408-417.
Austin, G. M. (a cura di), Microneurosurgical anastomoses for cranial ischemia, Springfield, Ill., 1976.
Backlund, E. O., Stereotactic radiosurgery in intracranial tumours and vascular malformations, in ‟Advances and technical standards in neurosurgery", 1979, VI, pp. 3-36.
Bancaud, J., Talairach, J., La stéréo-électroencéphalographie dans l'épilepsie, Paris 1965.
Bauer, R. B., Meyer, J. S., Fields, W. S., Remington, R., Mac Donald, M. C., Collen, P., Joint study of extracranial arterial occlusion. III. Progress report of controlled study of long-term survival in patients with and without operation, in ‟Journal of the American Medical Association", 1969, CCVIII, pp. 509-518.
Beks, J. W., Bosch, D. A., Brock, M. (a cura di), Intracranial pressure III, Berlin 1976.
Bergamini, L., Manuale di neurologia clinica, Torino 1983.
Berke, J. P., Buxton, L.F., Kormen, E., The empty sella, in ‟Neurology", 1975, XXV, pp. 1137-1143.
Björklund, A., Schmidt, R. M., Stenevi, U., Functional reinnervation of the neostriatum in the adult rat by use of intraparenchimal grafting of dissociated cell suspensions from the substantia nigra, in ‟Cell tissue research", 1980, CCXII, pp. 39-45.
Blaisdell, W. F., Clauss, R. H., Galbraith, J. G., Imparato, A. M., Wylie, E. J., Joint study of extracranial arterial occlusion. IV. A review of surgical considerations, in ‟Journal of the American Medical Association", 1969, CCIX, pp. 1889-1895.
Bonica, J., The management of pain, Philadelphia 1953.
Braakman, R., Cervical spondylotic myelopathy, in ‟Advances and technical standards in neurosurgery", 1979, VI, pp. 137-169.
Brewer, N. S., Maccarty, C. S., William, E. W., Brain abscess: a review of recent experience, in ‟Annals of internal medicine", 1975, LXXXII, pp. 571-576.
Bricolo, A., Gentilomo, A., Rosadini, G., Rossi, G. F., Long-lasting post-traumatic unconsciousness. A study based on nocturnal EEG and poligraphic recording, in ‟Acta neurologica scandinavica", 1968, XLIV, pp. 512-532.
Brock, M., Dietz, H. (a cura di), Intracranial pressure, Berlin 1972.
Brock, M., Fieschi, C., Ingvar, D. H., Lassen, N. A., Schurmann, K., Cerebral blood flow, Berlin 1969.
Caveness, W. F., Incidence of cranio-cerebral trauma in the United States in 1979 with tread from 1970-1975, in ‟Advances in neurology", 1979, XXII, pp. 1-3.
Clark, K., Injuries to the lumbar spine, in Neurological surgery (a cura di J. R. Youmans), vol. IV, Philadelphia 1982, pp. 2356-2361.
Cohen, H. L., Brumlik, J., Manual of electromyography, Hagerstown, Md., 1976.
Cook, A. W., Weinstein, S. P., Chronic dorsal column stimulation in multiple sclerosis, in ‟New York State medical journal", 1973, LXXIII, pp. 2868-2872.
Cooper, I. S., Involuntary movement disorders, New York 1969.
Cooper, I. S., Amin, I., Riklan, M., Waltz, J. M., Poon, T. P., Chronic cerebellar stimulation in epilepsy, in ‟Archives of neurology", 1976, XXXIX, pp. 559-570.
Cooper, I. S., Riklan, M., Amin, I., Waltz, J. M., Cullinam, T., Chronic cerebellar stimulation in cerebral palsy, in ‟Neurology", 1976, XXVI, pp. 744-753.
Dandy, E. W., Ventriculography following the injection of air into the cerebral ventricles, in ‟Annals of surgery", 1918, LXVIII, pp. 5-11.
D'Antona, A., La nuova chirurgia del sistema nervoso centrale, 2 voll., Napoli 1893-1894.
David, M., Pourpre, H., Lepoire, J., Dilenge, D., Neurochirurgie, Paris 1961.
Davis, L., Davis, R.A., Principles of neurological surgery, Philadelphia 1963.
Di Chiro, G., Reames, P. M., Matthews, W., Risa ventriculography and risa cisternography, in ‟Neurology", 1968, XXVIII, pp. 522-529.
Di Rocco, C., Caldarelli, M. (a cura di), Mielomeningocele, Roma 1983.
Di Rocco, C., Maira, G., Rossi, G. F., Vignati, A., Cerebrospinal fluid pressure in normal pressure hydrocephalus and cerebral atrophy, in ‟European neurology", 1976, XIV, pp. 119-128.
Dolce, G., Künkel, H. (a cura di), Computerized EEG analysis, Stuttgart 1975.
Donaghy, R., Yasargil, M. G., Microvascular surgery, St. Louis 1971.
Doppman, J. L., Di Chiro, G., Ommaya, A., Percutaneous embolization of spinal cord arteriovenous malformations, in ‟Journal of neurosurgery", 1971, XXXIV, pp. 48-55.
Drake, C. G., Cerebral aneurysm surgery; an update, in Cerebral vascular desease, New York 1976.
Fazio, C., Loeb, C., Neurologia, Roma 1984.
Fein, J. M., Reichman, O. H. (a cura di), Microvascular anastomoses for cerebral ischemia, New York-Berlin-Heidelberg 1978.
Fields, W. S., Maslenikow, U., Meyer, J. S., Remington, R. D., MacDonald, M. C., Joint study of extracranial arterial occlusion. V. Progress report of prognosis following surgery or non surgical treatment for transient ischemic attacts and cervical carotid lesions, in ‟Journal of the American Medical Association", 1970, CCXI, pp. 1193-2003.
Galli, G. (a cura di), Craniosynostosis, Boca Raton 1984.
Gardner, W. J., The dysraphic states from syringomielia to anencephaly, Amsterdam 1973.
Gawler, J., Bull, J. W., Du Boulay, G., Marshall, J., Computerized axial tomography with the emi-scanner, in ‟Advances and technical standards in neurosurgery", 1975, II, pp. 4-32.
Gillingham, F. J., Gybels, J,. Hitchcock, E. R., Rossi, G. F., Szikla, G. (a cura di), Advances in stereotactic and functional neurosurgery 4, in ‟Acta neurochirurgica", 1980, suppl. 30.
Goodman, S. J., Stern, W. E., Cranial and intracranial bacterial infections, in Neurological surgery (a cura di J. R. Youmans), vol. VI, Philadelphia 1982, pp. 3323-3357.
Gotoh, F., Nagai, H., Tazaki, Y. (a cura di), Cerebral blood flow and metabolism, in ‟Acta neurologica scandinavica", 1979, LX, suppl. 72.
Gros, C., Spasticity. Clinical classification and surgical treatment, in ‟Advances and technical standards in neurosurgery", 1979, VI, pp. 55-97.
Guidetti, B., Giuffrè, R., Valente, V., Italian contribution to the origin of neurosurgery, in ‟Surgical neurology", 1983, XX, pp. 335-346.
Gybels, J., The suggested mechanicsms of chronic pain and the rationale of neurosurgical treatment, in ‟Acta neurochirurgica", 1984, suppl. 33, pp. 397-406.
Gybels, J., Hitchcock, E. R., Ostertag, Ch., Rossi, G. F., Siegfried, J., Szikla, G. (a cura di), Advances in stereotactic and functional neurosurgery 6, in ‟Acta neurochirurgica", 1984, suppl. 33.
Hakim, S., Adams, R. D., The special clinical problem of symptomatic hydrocephalus with normal cerebro-spinal fluid pressure, in ‟Journal of neurological sciences", 1965, II, pp. 307-327.
Hidlebrand, J., Brihaye, J., Chemiotherapy of brain tumours, in ‟Advances in stereotactic and functional neurosurgery", 1978, V, pp. 51-91.
Horrax, G., Neurosurgery. An historical sketch, Springfield, Ill., 1952.
Hounsfield, G. N., Computerized transverse axial scanning (tomography). Part I: description of the system, in ‟British journal of radiology", 1973, XLVI, pp. 1016-1022.
Howe, J. R., Manual of patient care in neurosurgery, Boston-Toronto 1983.
Jannetta, P. J., Microsurgical approach to the trigeminal nerve for tic douloureux, in ‟Progress in neurological surgery", 1976, VII, pp. 180-200.
Jennett, W. B., An introduction to neurosurgery, London 1970.
Jirout, J., Pneumoencephalography, Springfield, Ill., 1969.
Jordan, R. M., Kendall, J. W., Kerber, C. W., The primary empty sella syndrome: analysis of the clinical characteristics, radiographic features, pituitary function and cerebrospinal fluid adneohypophiseal hormone concentration, in ‟American journal of medicine", 1977, LXII, pp. 569-580.
Katzman, R., Hussey, F., A simple constant-infusion manometric test for measurement of CSF absorption. I. Rationale and method, in ‟Neurology", 1970, XX, pp. 534-544.
Kempe, L.G., Operative neurosurgery, 2 voll., Berlin-Heidelberg-New York 1968.
Kernohan, J. W., Sayre, G. P., Tumors of the central nervous system, in Atlas of tumor pathology, esz. X, fascicoli 35 e 37, Washington 1952.
Kety, S. S., Schmidt, C. F., The determination of cerebral blood flow in man by the use of nitrous oxide in low concentrations, in ‟American journal of physiology", 1945, CXLIII, pp. 143-153.
Kohler, P.O., Ross, G.T. (a cura di), Diagnosis and treatment of pituitary tumors, Amsterdam-New York 1973.
Kooi, K. A., Fundamentals of electroencephalography, New York 1971.
Lazorthes, Y., Gouarderes, Ch., Verdie, J. C., Monsarrat, B., Bastide, R., Campan, L., Alwan, A., Cros, J., Analgésie par injection intrathécale de morphine, in ‟Neurochirurgie", 1980, XXVI, pp. 159-164.
Lee, B. C. P., Gawler, J., Computerized tomography of the spine and spinal cord, in ‟Radiology", 1978, CXXVIII, pp. 95-102.
Leksell, L., Echoencephalography. I. Detection of intracranial complications following injury, in ‟Acta chirurgica scandinavica", 1955-1956, CX, pp. 301-315.
Leksell, L., Echoencephalography. II. Midline echo from the pineal body as an index of pineal displacement, in ‟Acta chirurgica scandinavica", 1958, CXV, pp. 255-259.
Lenzi, G. L., Jones, T., Franckoviak, R. S., Positron emission tomography: state of art in neurology, in ‟Progress in nuclear medicine", 1981, VII, p. 118.
Lenzi, M., Salvolini, U., Neuroradiologia, Modena 1978.
Lundberg, N., Pontén, U., Brock, M. (a cura di), Intracranial pressure II, Berlin 1975.
Macchi, G., Malattie del sistema nervoso, in Manuale di medicina interna (a cura di P. Larizza), vol. IX, Padova 1981.
Mc Laurin, R. L. (a cura di), Head injuries, New York 1976.
Mc Laurin, R. L. (a cura di), Myelomeningocele, New York 1977.
Magnus, O., Lorentz de Haas, A. M. (a cura di), The epilepsies, in Handbook of clinical neurology (a cura di P. J. Vinken e G. W. Bruyn), vol. XV, Amsterdam 1974.
Maira, G., Anile, C., Cioni, B., Menini, E., De Marinis, L., Barbarino, A., Relationship between intracranial pressure and diurnal prolactin secretion in primary empty sella, in ‟Neuroendocrinology", 1984, XXXVIII, pp. 102-107.
Maira, G., Anile, C., Sterzi, S., Microchirurgia transfenoidale degli adenomi ipofisari secernenti prolattina, in ‟Atti del X congresso SIFES", Roma 1980, pp. 364-380.
Malis, L. I., Arteriovenous malformations of the spinal cord, in Neurological surgery (a cura di J. R. Youmans), vol. III, Philadelphia 1982, pp. 1850-1874.
Maniscalco, J. E., Habal, M. B., Craniofacial congenital malformations, in Neurological surgery (a cura di J. R. Youmans), vol. III, Philadelphia 1982, pp. 1467-1481.
Matson, D. D., Neurosurgery of infancy and childhood, Springfield, Ill., 1969.
Meglio, M., Percutaneously implantable chronic electrode for radiofrequency stimulation of the gasserian ganglion. A perspective in the management of trigeminal pain, in ‟Acta neurochirurgica", 1984, suppl. 33, pp. 521-525.
Meglio, M., Cioni, B., D'Amico, E., Ronzoni, G., Rossi, G. F., Epidural spinal cord stimulation for the treatment of neurogenic bladder, in ‟Acta neurochirurgica", 1980, LIV, pp. 191-199.
Meyerson, B. A., Hakansson, S., Alleviation of atypical trigeminal pain by stimulation of the gasserian ganglion with and implanct electrode, in ‟Acta neurochirurgica", 198, suppl. 30, pp. 303-309.
Milhorat, T. H., Pediatric neurosurgery, Philadelphia 1978.
Mingrino, S., Supratentorial arteriovenous malformations of the brain, in ‟Advances and technical standards in neurosurgery", 1978, V, pp. 93-123.
Moniz, E., L'encéphalographie artérielle, son importance dans la localization des tumeurs cérébrales, in ‟Revue neurologique", 1927, CCCXLII, pp. 72-90.
Moore, G. E., Use of radioactive diiodofluorescein in the diagnosis and localization of brain tumors, in ‟Science", 1948, CVII, pp. 569-571.
Morello, G., Pluchino, F., Chirurgia dei nervi periferici, in Trattato di tecnica chirurgica (a cura di A. Cordiano), vol. XIV, Padova 1983.
Moruzzi, G., Fisiologia della vita di relazione, Torino 1975.
Mullan, S., Essentials of neurosurgery, New York 1961.
Mullan, S., Lichtor, T., Percutaneous microcompression of the trigeminal ganglion for trigeminal neuralgia, in ‟Journal of neurosurgery", 1983, LIX, pp. 1007-1012.
Müller, H. R., Die transdurale Echoencephalographie, Bern-Stuttgart-Wien 1971.
Nooredenbos, W., Pain, Amsterdam 1959.
Northfield, D. W. C., The surgery of the central nervous system, Oxford 1973.
Nulsen, F. E., Spitz, E. B., Treatment of congenital hydrocephalus in infancy, in ‟Progress in neurological surgery", 1971, IV, pp. 289-328.
O'Brien, M. S., Hydrocephalus in children, in Neurological surgery (a cura di J. R. Youmans), vol. III, Philadelphia 1982, pp. 1381-1422.
Ojemann, G.A., Ward, A. A. Jr., Stereotactic and other procedures for epilepsy, in ‟Advances in neurology", 1975, VIII, pp. 241-263.
Omer, G. E., Spinner, M. (a cura di), Management of peripheral nerve problems, Philadelphia 1980.
Padula, V., Chirurgia cranio-cerebrale, Roma 1895.
Pagni, C. A., Lezioni di neurochirurgia, Torino 1978.
Pansini, A., Conti, P., Diagnostica angiografica dei tumori cerebrali sopratentoriali, Padova 1984.
Partain, C. L., Price, R. R., Rollo, F. D., James, A. E. Jr. (a cura di), Nuclear magnetic resonance (NMR) imaging, Philadelphia 1982.
Penfield, W., Jasper, H., Epilepsy and the functional anatomy of the human brain, Boston 1954.
Phelps, M. E., Hoffman, E. J., Mullani, N. A., Ter-Pogossian, M. M., Application of annihilation coincidence detection to transaxial reconstruction tomography, in ‟Journal of nuclear medicine", 1975, XVI, pp. 210-223.
Pool, J. L., Potts, D. G., Aneurysms and arterio-venous anomalies of the brain, New York 1965.
Popp, A. J. (a cura di), Neural trauma, New York 1979.
Poppen, J. L., An atlas of neurosurgical techniques, Philadelphia 1960.
Rand, R. W., Microneurosurgery, St. Louis 1978.
Remond, A. (a cura di), Handbook of electroencephalography and clinical neurophysiology, 16 voll., Amsterdam 1971-1978.
Riechert, J., Stereotaxic surgery for treatment of Parkinson's syndrome, in ‟Progress in neurological surgery", 1973, V, pp. 1-78.
Robertson, J. T., Auer, N. J., Extracranial occlusion disease of the carotid artery, in Neurological surgery (a cura di J. R. Youmans), vol. III, Philadelphia 1982, pp. 1559-1583.
Rockswold, G. L., Chou, S. N., Urological problems associated with central nervous system disease, in Neurological surgery (a cura di J. R. Youmans), vol. II, Philadelphia 1982, pp. 1031-1050.
Rosadini, G., Cavazza, B., Ferrillo, F., Siccardi, A., Simultaneous averaging of epileptic discharges in 14 channels: a computer technique, in ‟Electroencephalography nd clinical neurophysiology", 1974, XXXVI, pp. 541-544.
Rossi, G. F., Perspectives in international neurosurgery: neurosurgery in Italy, in ‟Neurosurgery", 1981, VIII, pp. 132-133.
Rossi, G. F., Colicchio, G., Genitlomo, A., Pola, P., Scerrati, M., Studyof the electrocerebral activity in partial epilepsies: its role for surgical treatment, in ‟Archives italiennes de biologie", 1982, CXX, pp. 160-175.
Rossi, G. F., Colicchio, G., Pola, P., Scerrati, M., La registrazione diretta dell'attività elettrica cerebrale dell'uomo nell'epilessia, in Corso di aggiornamento della Società italiana di EEG e neurofisiologia clinica, numero speciale della ‟Rivista italiana di EEG e neurofisiologia clinica", 1984, pp. 295-308.
Rossi, G. F., Di Rocco, C., Maira, G., Vignati, A., Caldarelli, M., Sonno REM e pressione intracranica, in ‟Rivista di neurologia", 1977, XLVII, pp. 570-580.
Rossi, G. F., Gentilomo, A., Colicchio, G., Le problème de la recherche de la topographie d'origine de l'épilepsie, in ‟Schweizer Archiv für Neurologie, Neurochirurgie und Psychiatrie", 1974, CXV, pp. 229-270.
Rossi, G. F., Maira, G., Surgical revascularization and brain function following completed stroke, in Investigation of brain function (a cura di A. W. Wilkinson), London 1981, pp. 217-238.
Rossi, G. F., Maira, G., Vignati, A., Intracranial pressure and pathogenesis of normotensive hydrocephalus, in Intracranial pressure II (a cura di N. Lundberg, U. Pontén e M. Brock), Berlin 1975, pp. 128-132.
Rossi, G. F., Pola, P., scerrati, M., Stability of interictal spike rate as an index of local epileptogenecity. A study based on computer analysis, in ‟Acta neurochirurgica", 1984, suppl. 33, pp. 69-73.
Rossini, P. M., Standardizzazione metodologica per l'applicazione clinica dei potenziali evocati in neurologia, in ‟Rivista italiana di EEG e neurofisiologia clinica", 1983, suppl. 2, pp. 1-61.
Rothman, R. H., Simeone, F. A. (a cura di), The spine, Phiiladelphia 1975.
Ruggiero, G., Trevisan, C., Cristi, G., Neuroradiologia in neurochirurgia, Torino 1977.
Russel, D. S., Rubinstein, L. J., Pathology of tumours of the nervous system, London 1963.
Russel, R. W. R., Brain and blood flow, London 1971.
Sachs, E., The history and development of neurological surgery, New York 1952.
Samii, M., Modern aspects of peripheral and cranial nerve surgery, in ‟Advances and technical standards in neurosurgery", 1975, II, pp. 33-85.
Scerrati, M., Arcovito, G., D'Abramo, G., Montemaggi, P., Pastore, G., Piermattei, A., Romanini, A., Rossi, G. F., Stereotactic interstitial irradiation of brain tumors, in ‟Rays", 1982, VII, pp. 93-99.
Scerrati, M., Rossi, G. F., The reliability of stereotactic biopsy, in ‟Acta neurochirurgica", 1984, suppl. 30, pp. 201-205.
Sedan, R., Lazorthes, Y., La neurostimulation électrique thérapeutique, in ‟Neurochirurgie", 1978, XXIV, suppl. 1, pp. 1-138.
Selecki, B. R., Williams, H. B. L., Injuries to the cervical spine and cord in man, Glebe, N. S. W., 1970.
Serbinenko, F.A., Balloon catherization and occlusion of major cerebral vessels, in ‟Journal of neurosurgery", 1974, XLI, pp. 125-145.
Shapiro, R., Myelography, Chicago 1975.
Shapiro, K., Marmarou, A., Portinoy, H. (a cura di), Hydrocephalus, New York 1984.
Sheline, G., Radiation therapy of brain tumors, in ‟Cancer", 1977, XXXIX, pp. 873-881.
Shulman, K., Marmarou, A., Miller, J. D., Becker, D. P., Hochwald, G. M., Brock, M. (a cura di), Intracranial pressure IV, Berlin 1980.
Siegfried, J., Hood, T., Current status of functional neurosurgery, in ‟Advances and technical standards in neurosurgery", 1983, X, pp. 19-79.
Smith, B. H., Cervical spondylosis and its neurological complications, Springfield, Ill., 1968.
Smorto, M., Basmatian, J. V., Clinical electroneurography, Baltimore 1972.
Spiegel, E. A., Wycis, H. T., Marks, M., Lee, A. J., Stereotaxic apparatus for operations on human brain, in ‟Science", 1947, CVI, pp. 349-350.
Spiess, H., Advances in computerized tomography, in ‟Advances and technical standard in neurosurgery", 1982, IX, pp. 51-68.
Steiner, L., Leksell, L., Greitz, T., Forster, D. M. C., Backlund, E. O., Stereotaxic radiosurgery for cerebral arterio-venous malformations, in ‟Acta chirurgica scandinavica", 1972, CXXXVIII, pp. 459-464.
Strandness, D. E. Jr., Doppler ultrasonic techniques in vascular disease, in Noninvasive diagnostic techniques in vascular disease (acura di E. F. Bernstein), St. Louis 1978, pp. 11-22.
Sweet, W. H., Intracerebral electrical stimulation for the relief of chronic pain, in Neurological surgery (a cura di J. R. Youmans), vol. VI, Philadelphia 1982, pp. 3739-3748.
Sweet, W. H., Wepsic, S. G., Controlled thermocoagultion of trigeminal ganglion and results for differential destruction of pain fibers. Part I. Trigeminal neuralgia, in ‟Journal of neurosurgery", 1974, XXXIX, pp. 143-156.
Szikla, G. (a cura di), Stereotactic cerebral irradiation, Amsterdam-New York-Oxford 1979.
Taveras, J. M., Diagnostic neuroradiology, Baltimore 1964.
Uematsu, S., Walker, A.E., A manual of echoencephalography, Kingston, Ont., 1970.
Van Alphen, H.A.M., Dreissen, J.J.R., Brin abscess and subdural empyema. Factors influencing mortality and results of various surgical techniques, in ‟Journal of neurology, neurosurgery and psychiatry", 1976, XXXIX, pp. 481-490.
Vigouroux, R.P., Guillermain, P., Post-traumatic hemispheric contusion and laceration, in ‟Progress in neurological surgery", 1981, X, pp. 49-163.
Vinken, P.J., Bruyn, G.W. (a cura di), Handbook of clinical neurology, vol. XXIII, Injuries of the brain and skull, Amsterdam 1975.
Vinken, P.J., Bruyn, G.W. (a cura di), Handbook of clinical neurology, vol. XXX, Congenital malformations of the brain and skull, Amsterdam 1977.
Visalli, F., La neurotraumatologia di oggi, Roma 1972.
Walker, A.E., A history of neurological surgery, Baltimore 1951.
Walker, A.E., Caveness, W.F., Critchley, Mac D. (a cura di), The late effects of head injury, Springfield, Ill., 1969.
Weinstein, M.A., Modic, M. T., Pavlicek, W.A., Intravenous digital substraction angiography of the head and neck, in ‟Clinical neurosurgery", 1981, XXIX, pp. 511-523.
Wertheimer, P., David, M., Naissance et croissance de la neurochirurgie, in ‟Neurochirurgie", 1979, XXV, pp. 247-366.
White, J.C., Sweet, W.H., Pain and the neurosurgeon, a 40 years experience, Springfield, Ill., 1969.
Wilson, C.B., Levin, V., Hoshino, T., Chemiotheraphy of brain tumors, in Neurological surgery (a cura di J. R. Youmans), vol. V, Philadelphia 1982, pp. 3065-3094.
Wise, R. J.S., Lenzi, G.L., Frackowiak, R. S. J., Application of positron emission tomography to neurosurgery, in ‟Advances and technical standards in neurosurgery", 1983, X, pp. 3-18.
Wright, R. L., Infections of the spine and spinal cord, in Neurological surgery (a cura di J. R. Youmans), vol. VI, Philadelphia 1982, pp. 3449-3458.
Yasargil, M. G., Microsurgery, Stuttgart 1969.
Yasargil, M.G., Fox, L. J., Ray, M. W., The operative approach to aneurysms of the anterior communicating artery, in ‟Advances and technical standards in neurosurgery", 1975, II, pp. 113-170.
Youmans, J. R. (a cura di), Neurological surgery, 6 voll., Philadelphia 1982.
Zuidema, G. D., Cohen, S. J., Pseudotumor cerebri, in ‟Journal of neurosurgery", 1954, XI, pp. 433-441.
Zülch, K. J., Types histologiques des tumeurs du système nerveux central, O. M. S., Genève 1979, pp. 1-72.
Zülch, K. J., Principles of the new World Health Organization (WHO) classification of brain tumors, in ‟Neuroradiology", 1980, XIX, pp. 59-66.
Chirurgia dei trapianti di Raffaello Cortesini
SOMMARIO: 1. Generalità: a) tipi di trapianto; b) evoluzione dei trapianti e rigetto; c) meccanismo del rigetto. □ 2. Elementi di immunologia: a) cellule immunocompetenti; b) istocompatibilità: ruolo del sistema HLA. □ 3. Elementi generali di clinica: a) il donatore di organi; b) la conservazione degli organi; c) diagnosi del rigetto; d) manipolazione immunologica; e) monitoraggio immunologico; f) trattamento antirigetto. □ 4. Il trapianto di rene: a) indicazioni; b) preparazione del ricevente e studio del donatore; c) aspetti tecnici; d) decorso postoperatorio e trattamento antirigetto; e) complicazioni del trapianto renale; f) risultati; g) conclusioni. □ 5. Il trapianto di fegato: a) indicazioni; b) tecnica chirurgica; c) complicanze; d) risultati; e) conclusioni. □ 6. Il trapianto di cuore: a) indicazioni; b) prelievo dal donatore; c) trapianto ortotopico; d) trapianto eterotopico; e) conclusioni. □ 7. Il trapianto di pancreas. □ 8. Il trapianto di altri organi. □ 9. Il trapianto di cervello. □ 10. Prospettive dei trapianti d'organo. □ Bibliografia.
1. Generalità.
a) Tipi di trapianto.
La chirurgia dei trapianti d'organo, dopo lunghi anni di ricerche sperimentali, sta entrando in una fase di sempre più larga applicazione clinica.
Le applicazioni chirurgiche del trapianto d'organo nel trattamento delle nefropatie terminali sono ormai un atto terapeutico acquisito, mentre i progressi realizzati nel trapianto di cuore, fegato, pancreas e midollo osseo non sono ancora pienamente riconosciuti come una vera e propria via terapeutica, pur rappresentando importanti fonti di acquisizioni capaci di aprirne.
Sorta in condizioni pionieristiche, la chirurgia dei trapianti ha compiuto in questi ultimi anni passi da gigante, grazie soprattutto al continuo sviluppo degli studi immunologici. Il fattore principale che limita l'utilizzazione dei trapianti nella pratica clinica è infatti l'elevata probabilità che una volta eseguito il trapianto l'organismo ospite lo rigetti.
Indubbiamente esistono ancora molti punti non del tutto definiti, soprattutto a livello del meccanismo del rigetto e delle metodiche di manipolazione immunologica per indurre nel ricevente la tolleranza dell'organo trapiantato, ma le conoscenze sinora acquisite costituiscono un importante corpo dottrinale.
Prima di iniziare una trattazione sistematica è bene definire i vari tipi di trapianto: a) autotrapianto o trapianto autologo: si ha quando il donatore è anche ricevente dell'organo, e pertanto nell'autotrapianto non c'è possibilità di rigetto; b) isotrapianto: si ha tra individui geneticamente identici, come è il caso dei gemelli monocoriali nell'uomo e quello delle linee singeniche o ceppi inbred negli animali; l'isotrapianto non presenta rigetto; c) allotrapianto: si ha tra individui della stessa specie, ma con corredo antigenico diverso; è questo il tipo più comune di trapianto e pone quasi sempre il problema del rigetto; d) xenotrapianto: è il trapianto tra individui di specie diverse ed è seguito da rigetto iperacuto o immediato.
b) Evoluzione dei trapianti e rigetto.
L'evoluzione di un autotrapianto è relativamente semplice; un innesto di cute nel ratto o nel topo subisce un normale processo di cicatrizzazione, l'epidermide si conserva di aspetto normale e su di essa ricrescono i peli.
L'evoluzione spontanea di un allotrapianto, invece, è completamente differente; negli innesti di cute omologa si può osservare un aspetto normale solo nei primi giorni, mentre a partire dal settimo giorno compaiono intorno ai capillari delle cellule mononucleate, molte delle quali sono pironinofile con citoplasma ricco di ribosomi, apparato del Golgi ben sviluppato, evidenti nucleoli e scarsi mitocondri. Queste cellule sono in stretto contatto con le cellule dell'epidermide. All'ottavo giorno si manifesta edema, in quanto alcuni dei piccoli vasi perdono il loro endotelio e si disintegrano causando emorragie. Negli altri vasi inizia un'infiltrazione di cellule linfoidi, si ha ostruzione del lume dovuta alla fibrina, danno vasale, necrosi e distruzione completa dell'innesto intorno al decimo giorno.
Il rigetto è una vera e propria risposta immune del ricevente: un primo innesto di cute viene generalmente rigettato in undici giorni (first set). Se dopo due settimane si procede a un altro innesto dal medesimo donatore, si ha il rigetto in sei giorni (second set). Un terzo innesto, sempre dal medesimo donatore, viene immediatamente rigettato e il rigetto è caratterizzato da intenso pallore ischemico (white graft).
La reazione immunologica di rigetto viene scatenata dagli antigeni specifici di istocompatibilità del donatore che, mediante una serie di eventi molto complessi, vengono riconosciuti come estranei dal ricevente, il cui sistema immunitario reagisce fino a distruggere l'organo trapiantato.
Possiamo distinguere vari tipi di rigetto: a) rigetto iperacuto: esso avviene pochi minuti dopo che è stata effettuata la rivascolarizzazione dell'organo trapiantato, che diventa cianotico, mentre l'esame istopatologico rivela una diffusa coagulazione intravascolare; b) rigetto acuto precoce: si verifica nel caso che sussista una presensibilizzazione del ricevente, per cui l'organo trapiantato può inizialmente funzionare in modo ottimale, ma presenta presto un rapido deterioramento della sua funzionalità; c) rigetto acuto cellulare: è la forma di rigetto più tipica e frequente, ma può essere dominata dalla terapia immunosoppressiva; nel trapianto renale l'aspetto istologico di questo tipo di reazione al momento di minor danno è rappresentato da un'infiltrazione perivascolare di cellule linfoblastiche, mentre negli stadi più avanzati si osserva anche infiltrazione interstiziale, edema con necrosi tubulare e passaggio perivascolare di cellule; d) rigetto cronico: in genere si verifica durante il primo anno dopo il trapianto e provoca un danno grave e irreversibile del rene trapiantato a livello della membrana basale del glamerulo, con conseguente necrosi glamerulare. Una terapia immunosoppressiva mirante a rendere reversibili le lesioni create rappresenta un gran rischio.
c) Meccanismo del rigetto.
Nel rigetto iperacuto il substrato immunalagico è rappresentato da anticorpi preformati che agiscono in maniera rapida provocando danni irreparabili, mentre il rigetto di tipo cronico è sostenuto prevalentemente dalla lenta produzione di anticorpi umorali che agiscono sulle pareti dei vasi provocando fenomeni di iperplasia con progressiva ostruzione del lume vasale.
Nel meccanismo del rigetto acuto si distinguono varie fasi: 1) fase di riconoscimento, che comprende il riconoscimento e l'elaborazione degli antigeni estranei; ciò può avvenire secondo due modalità: gli antigeni del donatore possono venir liberati dal trapianto e attraverso la circolazione venosa essere riconosciuti a livello dei linfonodi da parte dei linfociti T del ricevente; oppure i linfociti T del ricevente possono venir sensibilizzati passando attraverso l'organo trapiantato; 2) fase di attivazione: diverse sottopopolazioni cellulari, prevalentemente appartenenti ai linfociti T, attivano i linfociti B, stimolando la produzione di anticorpi e di mediatori e la proliferazione di cellule killer; anche i macrofagi vengono attivati; 3) fase di distruzione, in cui le cellule T del ricevente in fase attiva attaccano, attraverso i loro prodotti, il tessuto del trapianto.
2. Elementi di immunologia.
a) Cellule immunocompetenti.
Le cellule immunocompetenti, coinvolte nella interreazione tra organismo del ricevente e organo trapiantato, sono principalmente i linfociti (T, B e cellule K) e i macrofagi; tuttavia, va precisato che attualmente questa suddivisione in popolazioni cellulari definite appare troppo semplicistica.
1. Linfociti. - I linfociti sono un gruppo di cellule eterogenee dal punto di vista morfologico e ancora di più da quello funzionale. La classica distinzione in piccoli, medi e grandi linfociti, basata sulle dimensioni e sul rapporto nucleo/citoplasma, appare oggi del tutto insufficiente. Neanche la più recente suddivisione in linfociti T (timo-dipendenti) e B (borsa-dipendenti) appare oggi sufficiente, in quanto si conoscono numerose sottopopolazioni di linfociti T.
I linfociti T, sulla base del tipo di reazione alla quale prendono parte, si distinguono in: TC, citotossici nella risposta ad alloantigeni; THC, se amplificano l'azione dei TC; THB, helper, se coadiuvano con i B nella produzione di anticorpi; TS, suppressor, se impediscono tale processo.
Ancora non è del tutto chiaro se le molteplici capacità dei linfociti T corrispondono a una eterogeneità funzionale esistente prima della stimolazione antigenica o se sia proprio il contatto con l'antigene a indurre una suddivisione di compiti nell'ambito della stessa popolazione. Per l'immunologia dei trapianti questo è un punto chiave, in quanto se il differenziamento delle sottopopolazioni avviene prima del contatto con l'antigene, vuol dire che esso è regolato da meccanismi sui quali si può intervenire inducendo la tolleranza al trapianto; se, invece, dipende dall'antigene, sarà ogni volta diverso e non si potrà intervenire nei vari stadi di differenziazione.
L'altra grande popolazione linfocitaria è costituita dai linfociti B, che sono responsabili della produzione di anticorpi solubili.
Negli ultimi anni sono state eseguite numerose ricerche per individuare i vari stadi dello sviluppo delle cellule produttrici di anticorpi, o linfociti B, dalle forme primitive o slem cells del midollo osseo alle plasmacellule. Il differenziamento delle cellule midollari avviene normalmente nei tessuti linfatici periferici, dove si trasformano in B-immunoblasti, poi in B1, o proimmunociti, e infine in B2, o immunociti o plasmacellule. Probabilmente a un primo stadio di differenziazione i linfociti B, anche se sono immaturi per ciò che riguarda la produzione di anticorpi, hanno già dei marcatori immunoglobulinici di membrana che agiscono come recettori antigenici.
Negli Uccelli i linfociti B si sviluppano e si differenziano sotto l'influenza della borsa di Fabrizio, un organo linfoepiteliale che si trova nella parte dorsale della cloaca e che, per alcuni aspetti antigenici e morfologici, ricorda il timo. Nei Mammiferi non c'è un organo corrispondente alla borsa di Fabrizio, ma un sistema borsa-simile.
I linfociti B sono linfociti a vita breve, di soli tre o quattro giorni, hanno un ciclo riproduttivo velocissimo e sono capaci di proliferare in poche ore.
La partecipazione dei linfociti B al rigetto dei trapianti è legata alla produzione di anticorpi solubili diretti verso antigeni di istocompatibilità. È stato dimostrato che questi anticorpi, preformatisi nel ricevente a seguito di molteplici trasfusioni o di numerose gravidanze pregresse, sono responsabili del rigetto iperacuto.
Anticorpi solubili, formatisi in precedenza e diretti verso gli stessi antigeni, sarebbero responsabili del rigetto cronico.
È stata dimostrata anche l'esistenza di anticorpi facilitanti in grado di bloccare le colture miste linfocitarie, la unfocitotossicità e il Macrophage Migration Inhibitory Factor.
La natura di questi anticorpi facilitanti non è ancora ben chiarita: secondo alcuni potrebbe trattarsi di immunocomplessi antigene-anticorpo.
2. Cellule K e NK. - Le cellule K sono responsabili di un particolare tipo di citotossicità, l'ADCC (Antibody Dependent Cell-Mediated Cytotoxicity), e rappresentano una sottopopolazione di linfociti caratterizzata dal recettore Fc-IgG senza capacità aderenti, né fagocitanti; esse non posseggono immunoglobuline di membrana.
Nell'uomo l'attività delle cellule K è alta nella milza e nel sangue, meno nel midollo osseo e bassa nel tessuto linfoide. Esse rappresentano il 5% della popolazione totale del pool circolante.
Gli anticorpi coinvolti in questo tipo di reazione sono IgG. Sembra che l'ADCC possa essere sostenuta anche dai neutrofili e dai macrofagi, ed è quindi estremamente difficile mettere in evidenza l'ADCC dovuta solo alle cellule K, individuare quale sia il suo ruolo nel rigetto e quanto la presenza di tale citotossicità sia correlabile con l'insorgenza della crisi.
Le cellule NK (Natural Killer cells) sono responsabili, invece, di una citotossicità spontanea naturale cellulo-mediata: infatti sono capaci di riconoscere cellule estranee, specie tumorali, e di ucciderle senza previa sensibilizzazione. Rappresentano, quindi, una barriera naturale contro le cellule maligne, ed è stata trovata una correlazione tra presenza di cellule NK e difesa anti-tumore.
3. Macrofagi. - Già dal 1923 A. Sabin aveva individuato nei macrofagi le cellule capaci di riconoscere l'antigene e di innescare il meccanismo di produzione di anticorpi. L'importanza attribuita ai macrofagi nella risposta immunitaria è sembrata diminuire quando, intorno al 1960, si cominciò a chiarire come il ruolo preminente fosse svolto dai linfociti; infatti questi ultimi sono in grado di riconoscere l'antigene anche senza l'aiuto dei macrofagi. Recentemente, tuttavia, si è accertato che i componenti della risposta immune sono tre: macrofagi, linfociti T e linfociti B.
È ormai chiaro che i macrofagi sono strettamente legati alla presentazione dell'antigene ai linfociti T: infatti nell'innescare la risposta essi agiscono come ponte essenziale per l'interazione tra le diverse cellule. Perché i linfociti T ottengano il segnale dell'antigene legato ai macrofagi, è necessario un contatto fisico con essi. Si hanno così almeno due tipi di contatto cellula-cellula: uno iniziale, reversibile e indipendente dall'antigene, e un altro stabile, dipendente dall'antigene, la cui associazione porta alla proliferazione cellulare.
Recenti lavori hanno inoltre dimostrato che i macrofagi regolano la produzione di anticorpi attraverso la secrezione di sostanze solubili che agiscono sui linfociti T e B. Attualmente le nostre conoscenze in questo campo sono scarse, ma indubbiamente, nel monitoraggio del rigetto, oltre ai problemi di base c'è da tener presente che l'insorgere d'infezioni, il trattamento immunosoppressivo o qualsiasi fenomeno che alteri il delicato equilibrio numericofunzionale dei macrofagi può rappresentare un fattore ulteriore che, sommandosi al complesso susseguirsi dei meccanismi immunobiologici, porta al rigetto.
I macrofagi che invadono i capillari dell'organo trapiantato vengono trattenuti in loco da una sostanza dalle caratteristiche chimiche non ben definite, il MIF (Macrophage Migration Inhibitory Factor), capace di immobilizzarli e aggredirli senza ucciderli.
Negli animali da esperimento e nell'uomo è stato dimostrato un altro mediatore, il MAF (Macrophage Activating Factor), prodotto dal contatto tra le cellule del ricevente sensibilizzate e gli antigeni del trapianto. Il MAF rende i macrofagi non specificamente citotossici, agendo senza provocare alterazioni sulla membrana, ma a livello endocellulare, soprattutto enzimatico: infatti i macrofagi eluiti dal trapianto presentano una diminuzione dei lisosomi, forse per una secrezione extracellulare che coadiuva la usi delle cellule target.
Riassumendo, possiamo concludere che i macrofagi esplicano la loro azione nel complesso meccanismo del rigetto sia per contatto diretto con i linfociti T nella presentazione dell'antigene, sia tramite la secrezione di sostanze linforegolatrici, sia per l'azione di mediatori quali il MIF e il MAF, e sono quindi tra i maggiori protagonisti del rigetto (v. immunologia clinica e immunopatologia).
b) Istocompatibilità: ruolo del sistema HLA.
La maggiore entità delle crisi di rigetto nel trapianto tra individui con marcata istoincompatibilità, rispetto a quelli con minori differenze genetiche, ha portato alla messa a punto di metodiche per la determinazione dell'istocompatibilità. Esse sono raggruppate nella tab. I. In pratica attualmente vengono impiegate la determinazione degli antigeni eritrocitari, la linfocitotossicità e le colture linfocitarie miste.
Recenti ricerche condotte da numerosi laboratori immunologici in Europa e negli Stati Uniti hanno permesso di definire la struttura del sistema HLA (Human Leukocyte Antigens), che controlla gli antigeni di istocompatibilità nell'uomo. È stato ormai quasi unanimemente accettato che ogni individuo può al massimo avere 10 antigeni di istocompatibilità. Essi sono controllati da una regione di una coppia di cromosomi (cromosomi 6), definita MHC (Major Histocompatibility Complex) o supergene HLA, in quanto definisce gli antigeni HLA (v. trapianti).
Nell'ambito di questa regione sono presenti tre loei per la produzione di antigeni sierologicamente definiti (SD), denominati HLA-A, HLA-B, HLA-C. Per l'elevato polimorfismo di ciascuno di questi loci le numerose possibili combinazioni degli alleli materni e paterni danno luogo a moltissimi fenotipi HLA diversi; tuttavia, poiché per le sue limitate dimensioni la regione HLA è di solito trasmessa dai genitori ai figli come un unico gene, due fratelli avranno una probabilità su 4 di ereditare gli stessi geni HLA e, conseguentemente, di possedere gli stessi antigeni linfocitari, la cui produzione è controllata da quei loci. Di questi antigeni SD, solo gli HLA-A e HLA-B sono relativamente importanti nei trapianti, mentre gli HLA-C lo sono meno.
Esiste infine un altro gruppo di antigeni, definiti LD (Lymphocyte Defined) in rapporto con la reattività dei linfociti nelle colture miste. Se, infatti, vengono coltivati insieme linfociti di due diversi individui, si verifica una proliferazione cellulare che è possibile determinare misurando l'assorbimento di timidina triziata somministrata alle cellule. Se le cellule di un individuo donatore vengono trattate con mitomicina, una volta poste in coltura esse non blastizzano, ma mantengono la loro antigenicità tanto da consentire lo studio delle differenze antigeniche che presentano nei confronti dei linfociti del ricevente. Il grado di reattività nella MLC (Mixed Lymphocyte Culture) è misura della differenza degli antigeni LD. Questi antigeni sono espressi geneticamente dallo stesso supergene HLA o MHC, anche se sono situati in punti differenti del cromosoma (locus D/DR). Attualmente essi vengono denominati antigeni HLA o HLA-DR a seconda della metodica di identificazione. Gli antigeni prodotti dal locus D/DR sono stati definiti sia con l'impiego della reazione linfocitaria in coltura mista utilizzando cellule omozigoti, sia bloccando la MLC con antisieri, sia usando linfociti sensibilizzati (primed) capaci di dare una risposta secondaria a contatto o con cellule ignote, aventi sulla superficie antigeni rilevanti, o, come si è recentemente dimostrato, con antisieri specifici.
Esistono dunque differenti loci nel sistema maggiore di istocompatibilità. Essi sono:
1° locus = HLA-A;
2° locus = HLA-B;
3° locus = HLA-C;
locus D = HLA-D/HLA-DR.
In relazione a ciascun locus sono stati identificati diversi antigeni mediante accurate tecniche sierologiche (linfocitotossicità, leucoagglutinazione, ecc.) e studi comparati effettuati in numerosi laboratori. È stato così possibile evidenziare una serie di specificità HLA che consentono di caratterizzare ciascun individuo dal punto di vista degli antigeni di istocompatibilità (v. tab. II): questo studio si chiama tipizzazione. In pratica, esponendo in vitro i linfociti di un determinato soggetto ad antisieri monospecifici noti, si osserva lisi cellulare solo quando si impiega l'antisiero in grado di reagire specificamente con l'antigene posseduto da quei linfociti. Un soggetto avrà così una tipizzazione definita dall'espressione di 2 antigeni a ciascun locus, ad esempio:
HLA-A = A1, A9;
HLA-B = B5, Bw16;
HLA-C = Cw4, Cw5;
HLA-D/DR = Dw3, Dw4.
Gli antigeni A e B sono quelli che vengono correntemente identificati, ma numerosi laboratori tipizzano attualmente anche gli antigeni DR; inoltre alcuni di questi antigeni presentano il fenomeno della reattività crociata, per cui in realtà il numero degli antigeni realmente determinanti l'istocompatibilità tra donatore e ricevente tende a essere più ridotto di quanto non si ritenesse in passato.
Nella combinazione genitori-figli si ritrova sempre un aplotipo (allele HLA) in comune, ossia la metà degli antigeni HLA sarà la stessa, mentre gli altri saranno quasi sempre differenti. La coppia verrà così definita aploidentica e semidentica.
Se si esegue la tipizzazione di una coppia donatore (D)ricevente (R) costituita da due fratelli, come accennato in precedenza, si ha una probabilità su quattro che abbiano ricevuto il medesimo aplotipo sia paterno che materno (in tal caso si definiscono fratelli HLA identici), due probabilità su quattro che abbiano in comune uno solo dei due aplotipi (fratelli HLA aploidentici o semidentici) e una probabilità su quattro che differiscano a livello dei due aplotipi (fratelli HLA differenti).
Infine, in base a precise formule matematiche che tengono conto anche della frequenza genica e del numero di antigeni testati, è possibile calcolare esattamente le incompatibilità totali presenti o potenziali (IN) esprimendole numericamente. Questa precisa determinazione è estremamente utile non solo nei trapianti renali tra consanguinei, ma anche nei trapianti da donatore cadavere, come dimostrato da una ricca casistica. I risultati discordanti ottenuti dai vari gruppi di ricerca sono, a nostra opinione, da attribuire al mancato riconoscimento della reale importanza del locus HLA-D.
Anche le più recenti esperienze confermano pienamente il ruolo svolto dal sistema HLA complessivamente considerato a livello di tutti i suoi determinanti.
Recentemente sono stati presentati i dati Eurotransplant sull'importanza della tipizzazione HLA-DR, eseguita impiegando anticorpi specifici che consentono il riconoscimento degli antigeni HLA-D o i determinanti strettamente collegati a essi, definiti HLA-DR: in 237 trapianti renali, a 6 mesi, la sopravvivenza del trapianto è stata del 92% nei casi con 2 antigeni HLA-DR in comune, dell'80% nei casi con 1 antigene HLA-DR in comune e del 66% nei casi senza antigeni HLA-DR in comune. Questi dati chiaramente dimostrano che il trapianto renale nei casi in cui vi siano i due antigeni DR in comune consente una eccellente funzionalità del trapianto e che anche nei casi con un solo antigene DR in comune si ha una significativa riduzione dell'incidenza del rigetto nei primi mesi post-trapianto.
Anche altri gruppi di ricercatori hanno condotto studi similari riportando analoghi risultati. I dati disponibili dimostrano pertanto che la selezione di coppie donatore-ricevente con due antigeni HLA-DR in comune migliora in modo significativo la sopravvivenza del trapianto. Inoltre, i controlli bioptici e funzionali a distanza hanno dimostrato che i risultati migliori si ottengono nei casi con più elevata istocompatibilità.
È da rilevare, però, che anche nei trapianti tra fratelli HLA identici è necessario somministrare farmaci immunosoppressivi, mentre solo gli autotrapianti e i trapianti tra gemelli omozigoti (isotrapianti) attecchiscono senza terapia immunosoppressiva. È ovvio dunque che le attuali metodiche di tipizzazione, combinate con la determinazione del gruppo ABO, non danno il quadro completo dell'istocompatibilità e che debbono esistere altri antigeni di trapianto non evidenziabili con le tecniche correntemente impiegate: infatti a parità di tipizzazione degli antigeni SD, i trapianti tra consanguinei danno migliori risultati di quelli tra non consanguinei. Tali determinanti antigenici geneticamente collegati, tuttavia, non sono stati ancora messi in evidenza.
Vogliamo ricordare a questo proposito l'esistenza di un sistema poliallelico alloantigenico controllato da determinanti genetici nella stessa regione cromosomica MHC, che è verosimilmente l'omologo del sistema Ia identificato negli animali da esperimento. È stato dimostrato che questo sistema è controllato da geni strettamente collegati alla regione HLA-D e codificato da loci contenuti nella regione HLA-D. Nell'Histocompatibility Workshop 1977 è stato delineato questo sistema, presente soprattutto a livello dei linfociti B. L'importanza di questo sistema è indubbia: gli antigeni Ia svolgono un ruolo determinante nell'attivazione della reazione di rigetto, come dimostrato da ricerche in vitro e in vivo.
Infine dobbiamo rilevare che, oltre agli antigeni HLA-D, esistono altre strutture antigeniche che influenzano la sopravvivenza del trapianto e che non sappiamo ancora identificare nella tipizzazione.
Il mosaico dell'istocompatibilità è attualmente in via di completo chiarimento e comunque la maggior parte dei fenomeni è già stata esattamente delineata. Un immenso lavoro è stato svolto negli ultimi 10 anni e le applicazioni cliniche sono molteplici anche al di fuori del settore dei trapianti (v. trapianti).
3. Elementi generali di clinica.
a) Il donatore di organi.
Indipendentemente dal problema della tipizzazione, trattato in precedenza, il donatore può essere preso in considerazione dal punto di vista biologico e funzionale se soddisfa a determinati criteri. Questi sono naturalmente alquanto diversi a seconda che si tratti di un donatore vivente, nel caso del trapianto renale, o di un donatore cadavere. Nel primo caso la valutazione fisico-psichica deve essere estremamente accurata e nulla deve essere tralasciato nello studio della funzione renale, per essere sicuri che il soggetto negli anni successivi non dovrà subire alcun deterioramento del rene residuo. L'individuo deve essere perfettamente sano, psicologicamente equilibrato, libero nel dare il consenso, affettivamente motivato e pienamente cosciente del suo gesto di donazione. La minima imperfezione, il sospetto di qualsiasi affezione anche potenziale impone l'eliminazione del soggetto come donatore vivente.
Diverso è invece il tipo di selezione da effettuare nel caso di un donatore cadavere: si esige un'età biologicamente non senescente, approssimativamente inferiore ai cinquant'anni, assenza di antecedenti di malattie infettive o tumorali. Generalmente la causa di morte dei soggetti prescelti è una lesione cerebrale irreversibile, quale si verifica per trauma cranico, tumore primitivo cerebrale, emorragia o trombosi cerebrale.
Particolari cautele nel trattamento di questi potenziali donatori sono messe in atto nei centri di rianimazione, dopo che è stato fatto ogni tentativo per recuperarli alla vita. In tal modo è possibile mantenere in maniera soddisfacente la funzione degli organi utilizzabili ai fini del trapianto durante il prescritto periodo cautelativo di attesa, una volta che sia stata accertata la morte dell'individuo, secondo i parametri schematizzati nella tab. III, che è ricavata dall'attuale legislazione italiana (v. anche rianimazione).
Il prelievo degli organi da donatore cadavere, una volta espletate tutte le formalità prescritte, deve essere eseguito in modo tecnicamente perfetto, e ugualmente perfetto deve essere il modo di conservazione dello o degli organi, il cui trasferimento al centro chirurgico dei trapianti avviene con il sistema più rapido possibile per evitare gravi deterioramenti del trapianto. Questo sistema appare più semplice del trasferimento del cadavere in toto al centro per i trapianti, anche se in molti casi si è sinora proceduto in tal modo.
b) La conservazione degli organi.
Alla temperatura normale del corpo (36-37 °C) i differenti organi, in situazione di arresto della circolazione, presentano lesioni irreparabili dopo un tempo critico variabile da organo a Organo. Il cervello ha un tempo critico di 3-5 minuti, il fegato di 15-20 minuti, il cuore e i polmoni di 30-40 minuti, il rene di 50-100 minuti, mentre la cornea e la pelle conservano la loro vitalità per un tempo che arriva a 60 minuti.
Indubbiamente la sofferenza dell'organo durante il trapianto è tanto minore quanto minore è stato l'intervallo di tempo durante il quale è rimasto privo di sangue ossigenato, a meno che non si instauri una particolare metodica protettiva. Le tecniche di conservazione degli organi si sono sviluppate per consentire, appunto, la protezione più efficace degli organi durante la fase esangue. La metodica più semplice è basata sul raffreddamento dell'organo sino a 6-8 °C. A tale temperatura il consumo di ossigeno è ridotto a meno del 10 per cento del consumo basale e pertanto l'organo può essere conservato per diverse ore in buone condizioni. Con il semplice raffreddamento e il lavaggio dell'organo con particolari soluzioni, un rene può essere attualmente conservato senza danni per 24-30 ore e ciò ne consente il trasporto anche da una nazione all'altra.
Una metodica più elaborata consiste nell'introdurre il rene in un apparato che lo perfonde continuamente con una particolare soluzione ossigenata a bassa temperatura. Reni umani sono stati conservati in tal modo sino a 72 ore con riprese ottimali della funzione dopo il trapianto.
Si è tentato di surgelare gli organi portandoli a bassa temperatura in azoto liquido, ma non si è riusciti a risolvere il problema del danneggiamento che fatalmente gli organi subiscono durante il successivo riscaldamento. Sono però in fase di studio tecniche che utilizzano tra l'altro raggi infrarossi, che sembrano consentire un più armonico ripristino della vitalità cellulare nella fase di ritorno alla temperatura normale. Indubbiamente le nostre conoscenze sulla biologia delle basse temperature (criobiologia) sono ancora molto limitate e i progressi ottenuti sono del tutto empirici. L'importanza delle ricerche in questo campo non deve però essere sottovalutata, perché le applicazioni cliniche del trapianto di cuore e di fegato, divenendo sempre più numerose, renderanno necessaria l'utilizzazione di tutti gli organi disponibili su scala internazionale.
c) Diagnosi del rigetto.
Il rigetto è un fenomeno biologico multifocale, sostenuto cioè da una serie di meccanismi di ordine cellulare e umorale, che si manifestano a livello dapprima microscopico e successivamente macroscopico, sino a determinare la disfunzione, il danneggiamento e infine la distruzione dell'organo trapiantato. Il rigetto può e deve essere diagnosticato durante la prima fase, quando solo la funzione è alterata: la diagnosi precoce è infatti la migliore tattica per controllarlo e dominarlo.
Ogni organo presenta sintomi di rigetto comuni agli altri organi e sintomi propri, peculiari, come peculiare è la funzione di ogni organo. È indispensabile pertanto conoscere questi sintomi, di ordine generale e di ordine particolare, per poter effettuare il trattamento antirigetto il più tempestivamente possibile. Bisogna precisare, a titolo di premessa, che, nonostante siano stati elaborati metodi sofisticati per diagnosticare il rigetto dei vari organi, il più sicuro e più valido è ancora l'intuito e l'esperienza clinica del medico che controlla il paziente trapiantato e che ha imparato, dopo anni di assiduo lavoro clinico-sperimentale, a valutare l'importanza dei vari segni e sintomi nel contesto dei dati di laboratorio rilevati nel paziente.
Il rigetto del rene può essere diagnosticato dal rilevamento di un modico aumento dei valori dell'azotemia associato a una diminuzione della diuresi non spiegabile in altro modo, mentre la comparsa di un'aritmia o di un ritmo di galoppo fanno fortemente sospettare un iniziale rigetto cardiaco.
Il rigetto del fegato può invece essere denunciato da un aumento della bilirubina nel sangue associato ad altri sintomi di ritenzione dei sali biliari.
Molto più agevole e purtroppo più drammatico è diagnosticare il rigetto allorché è in fase conclamata, quando il danno dell'organo è molto evidente anche dal punto di vista clinico. Si osservano marcata riduzione della diuresi con ingrandimento dell'organo nel caso del rigetto renale, scompenso cardiaco e versamento pericardico nel rigetto del cuore, ascite ed emorragie nel rigetto del fegato.
Il rigetto del polmone è invece più complesso, perché invariabilmente è associato a fenomeni infiammatori di tipo bronco-pneumonico che rendono ardua e pressoché impossibile una corretta impostazione non solo della diagnosi, ma anche della terapia più opportuna.
Il rigetto entra successivamente nella fase di irreversibilità, in cui l'organo è ormai definitivamente compromesso: si tratta di un vero e proprio marasma biologico, in cui non soltanto la funzione dell'organo va spegnendosi, ma tutto l'organismo è in preda a un perturbamento complesso e difficilmente controllabile. La rapidità con cui si instaura il rigetto può però essere assai variabile ed è possibile distinguere forme di rigetto assai violente (rigetto iperacuto) da forme di tipo acuto e di tipo cronico. Mentre le prime si instaurano immediatamente dopo il trapianto o nei giorni successivi, le forme di rigetto cronico possono comparire a distanza di settimane, di mesi e anche di anni. Tutto ciò rende multiforme e complessa la diagnosi clinica di rigetto e impone il proseguimento e l'approfondimento di ricerche fisiopatologiche e immunobiologiche miranti a definire nei particolari tutti i diversi fenomeni che concorrono a scatenare questa reazione biologica.
d) Manipolazione immunologica.
È una delle vie più promettenti per il controllo della reazione di rigetto. Con questo termine, da noi coniato nel 1978, intendiamo tutto ciò che riguarda lo studio degli aspetti morfologici e funzionali delle cellule deputate al controllo delle reazioni immunitarie dell'organismo e l'impiego di trattamenti farmacologici e radiologici tendenti, per quanto riguarda i trapianti d'organo, a prevenire e pilotare la risposta antitrapianto piuttosto che a modificare la strategia antirigetto convenzionale.
Nel meccanismo cellulare e nelle sue connessioni, sia dirette che attraverso mediatori, con i fenomeni di aggressione o di tolleranza che si instaurano, appaiono dominanti sia il ruolo delle cellule APC (cellule che presentano l'antigene), siano esse cellule dendritiche o altre cellule linfatiche, sia il differente ruolo degli antigeni di trapianto della classe I (HLA-A-B-C) e della classe Il (HLA-D/DR; v. tab. Il). Inoltre appare evidente l'importanza delle cellule T helper e delle cellule T suppressor/citotossiche.
Lo studio della manipolazione immunologica presuppone il monitoraggio immunologico, attualmente effettuato con il controllo di molteplici sottopopolazioni cellulari e di altri meccanismi immunologici (v. tab. IV).
La citometria di flusso associata alla separazione cellulare consente una determinazione rapida e sequenziale delle varie fasi della manipolazione immunologica.
Le metodiche di manipolazione immunologica, partendo dalla immunosoppressione convenzionale, si sono man mano evolute passando dapprima attraverso la fase delle trasfusioni di sangue programmate, successivamente attraverso le trasfusioni di sangue specifiche del donatore senza o con simultanea somministrazione di citostatici (azatioprina), e poi attraverso la fase dell'irradiazione linfatica totale (TLI) associata al trattamento immunofarmacologico.
e) Monitoraggio immunologico.
La più approfondita conoscenza del meccanismo di rigetto con l'interazione dei fattori cellulari e umorali ha reso possibile l'impostazione di un vero e proprio monitoraggio immunologico del trapianto, i cui obiettivi possono essere schematizzati nel modo seguente.
1. Determinare le reattività linfocitarie e la presenza di anticorpi: a) prima del trapianto; b) immediatamente dopo; c) a distanza.
2. Studiare i linfociti T e B: a) nelle variazioni percentuali e assolute; b) nelle mutazioni che i recettori subiscono; c) nel rafforzamento o nella deplezione di alcune sottopopolazioni.
3. Monitorizzare la crisi del rigetto.
4. Dosare i farmaci immunosoppressivi in modo più selettivo e graduale.
Quando si tenta di effettuare un trapianto tra individui altamente incompatibili, i test immunologici pre-trapianto riportati nella tab. IV hanno importanza fondamentale, al fine di evitare un rigetto iperacuto o per attenuare l'entità del rigetto acuto. Per quanto riguarda il monitoraggio post-trapianto, esso è fondato sull'esecuzione contemporanea di più test, al fine di rilevare correlazioni tra i dati di laboratorio e i dati clinici e anche correlazioni in vitro-in vitro, cioè tra i test stessi. Un'attenta valutazione dei risultati di questi test, correlata ai dati clinici e agli esami biochimici per la valutazione della funzionalità renale, consente di effettuare una diagnosi precoce di crisi di rigetto.
f) Trattamento antirigetto.
L'obiettivo finale delle ricerche sul trattamento antirigetto è quello di ottenere l'accettazione definitiva dell'organo trapiantato, senza dover ricorrere ad alcun trattamento farmacologico di mantenimento. Questo stato di accettazione pacifica e definitiva del trapianto si definisce ‛induzione della tolleranza'. Si conoscono differenti metodiche sperimentali per indurre la tolleranza, ma attualmente nessuna di esse è tanto perfezionata da poter essere applicata su larga scala nell'uomo. Si ricorre quindi a trattamenti immunodepressivi con vari farmaci che inducono uno stato di parziale tolleranza associato a una riduzione più o meno marcata dei poteri immunitari di difesa dell'organismo.
Il farmaco più impiegato è stato senza dubbio l'azatioprina (Imuran), un derivato della 6-mercaptopurina, impiegato un tempo come farmaco antileucemico. Questo preparato chimico interferisce con la sintesi degli acidi nucleinici e pertanto impedisce la proliferazione cellulare, soprattutto a livello delle cellule a rapida moltiplicazione, come quelle del midollo osseo e dell'intestino. Tra queste cellule sono comprese quelle che producono anticorpi antitrapianto e in tal modo l'Imuran agisce efficacemente come farmaco antirigetto. È necessario però controllare continuamente il livello dei leucociti circolanti nel sangue, per mantenere sempre un tasso di globuli bianchi sufficiente a difendere l'organismo da aggressioni batteriche (v. chemioterapia antineoplastica).
Il cortisone e i suoi derivati, come il metilprednisolone, grazie alla loro marcata azione antinfiammatoria e antilinfocitaria, sono i farmaci principe nel trattamento antirigetto, soprattutto allorché si tratta di sopprimere e bloccare una crisi di rigetto. Purtroppo ad alte dosi, e specialmente se viene somministrato per un lungo periodo di tempo, il cortisone provoca indesiderabili effetti collaterali, tra cui il peculiare aspetto dei pazienti, che presentano il viso ‛a luna piena', evidente soprattutto nel sesso femminile. Tale fenomeno tende però a scomparire con la riduzione del dosaggio.
Il siero antilinfocitario, o meglio una frazione di esso, la globulina antilinfocitaria (ALCI), è un preparato biologico che si ottiene iniettando linfociti umani nel cavallo o nella pecora o nel coniglio; questi animali sono così in grado di produrre anticorpi che specificamente distruggono o rendono inattivi i linfociti umani, che sono i maggiori responsabili del fenomeno del rigetto. Indubbiamente questo preparato presenta un'attività biologica antirigetto, soprattutto se somministrato ad alte dosi per via endovenosa nella fase iniziale pre- e post-trapianto.
Numerose ricerche hanno dimostrato la capacità delle radiazioni di indurre la tolleranza immunologica in allotrapianti di cute, cuore e altri organi in più specie animali.
L'irradiazione linfatica totale (TLI) è stata impiegata inoltre come terapia immunosoppressiva nei trapianti di midollo, per la prevenzione del rigetto e per impedire la GVH (Graft Versus Host). La sua azione si esplica su tutte le popolazioni linfocitarie inducendo una immunodepressione non selettiva con diminuzione globale delle cellule immunocompetenti, come confermato dagli studi da noi eseguiti sui sub-sets linfocitari.
Sulla base di queste considerazioni la TLI è stata impiegata presso il nostro Centro sia su pazienti a elevato rischio di rigetto irreversibile - high responders e ritrapiantati -, sia su pazienti affetti da diabete mellito con nefropatia diabetica, nei quali sono ben noti gli effetti collaterali gravi legati alla terapia steroidea. Il protocollo pre-trapianto - dose singola 125 rad, dose totale 1.500-3.000 rad - è stato associato nel periodo post-trapianto sia a terapia immunosoppressiva con siero antilinfocitario e bassi dosaggi di steroidi (16 mg/die), sia a terapia con ciclosporina. Entrambi i protocolli si sono dimostrati estremamente efficaci (v. tab. V), soprattutto con l'impiego della ciclosporina, che ha consentito di ridurre la dose totale di radiazioni, abolendo completamente la comparsa di alcuni effetti collaterali indesiderati, secondari alla somministrazione di elevate dosi di TLI.
La ciclosporina, polipeptide ciclico estratto nel 1972 presso i laboratori di ricerca Sandoz di Basilea da Trichoderma polisporum e da Cylindrocarpon lucidum, si differenzia dagli altri farmaci immunosoppressivi usati nella terapia convenzionale, in quanto agisce selettivamente sul linfocita immunocompetente (Th) responsabile dell'innesco della reazione di rigetto, senza esercitare alcuna azione antiblastica aspecifica. La sua azione si esercita impedendo la moltiplicazione del linfocita, bloccandolo nella fase G0 e nella prima parte della fase G1 della riproduzione cellulare; inoltre ostacola la formazione e il rilascio delle linfochine, specificamente l'interleuchina 2, impedendo così la normale cooperazione dei linfociti e la loro moltiplicazione.
La nostra esperienza con tale farmaco risale al maggio 1982 e riguarda il suo impiego clinico nei trapianti di rene, fegato e pancreas, secondo differenti protocolli, descritti nella tab. VI. In particolare, per quanto riguarda il trapianto renale, la ciclosporina ha permesso di modificare i parametri di selezione donatore-ricevente nel trapianto sia da donatore cadavere (v. tab. VII) sia da donatore vivente, allargando il pool dei potenziali donatori viventi ai soggetti non consanguinei ABO compatibili. La ciclosporina ha permesso infine di iniziare presso il nostro Centro un programma clinico di trapianto di fegato, poiché, con l'impiego di questo nuovo farmaco, si sono notevolmente ridotte le complicanze infettive postoperatorie, che hanno rappresentato sino a un recente passato la principale causa di mortalità dei pazienti sottoposti a questo tipo di interventi, che costituiscono una nuova branca della chirurgia sostitutìva.
4. Il trapianto di rene.
Il rene è stato il primo organo a essere trapiantato con successo nell'uomo. I primi interventi risalgono al 1954 e attualmente sono stati schedati oltre 75 mila trapianti renali (v. tab. VIII). L'incidenza di malattie renali a esito fatale nel nostro paese è chiaramente evidenziata da recenti dati, secondo i quali ammontano a oltre 7.500 i decessi annui legati a nefropatie. La grande maggioranza di queste affezioni renali è rappresentata dalla glomerulonefrite, seguono la pielonefrite e infine il rene policistico e le altre malformazioni congenite.
La presenza di uremia terminale costituisce un'indicazione assoluta per il trapianto renale. L'intervento può essere effettuato sia sugli adulti sia sui bambini, indipendentemente dal sesso. Devono essere esclusi i soggetti ultrasessantenni e anche pazienti con infezioni in atto, giacché la terapia immunosoppressiva può indurne un aggravamento. Si possono trapiantare anche pazienti affetti da nefropatia diabetica, da lupus eritematoso sistemico e da altre affezioni sistemiche, anche se il rischio in questi casi è molto elevato, per le numerose complicanze conseguenti al trattamento dialitico.
In questi ultimi anni la presenza di una pregressa infezione tubercolare non è più considerata come un ostacolo assoluto: infatti il trapianto può ugualmente conseguire in tali casi un risultato favorevole, se si associa alla terapia antirigetto un preventivo trattamento antitubercolare.
b) Preparazione del ricevente e studio del donatore.
L'uremico terminale viene preparato al trapianto mediante dialisi peritoneale o emodialisi. Spesso appartiene a un gruppo di malati in emodialisi periodica presso un centro nefrologico, o sta eseguendo emodialisi domiciliare.
I pazienti vengono sottoposti al trapianto perfettamente depurati, con le costanti ematochimiche il più vicino possibile alla norma. Nel caso di pazienti portatori di gravi infezioni renali o di voluminosi reni policistici è opportuno eseguire la nefrectomia bilaterale previamente al trapianto.
Nel donatore vivente devono essere effettuati tutti gli esami clinici e di laboratorio in grado di dimostrare una perfetta funzionalità renale, epatica, cardiocircolatoria e respiratoria. Si devono inoltre eseguire l'urografia, l'arteriografia e l'urinocoltura. L'indagine psichiatrica permetterà di accertare le condizioni mentali del donatore. L'osservazione sarà conclusa con la determinazione della tipizzazione.
Nel caso di un potenziale donatore cadavere si dovrà eseguire un controllo della funzione renale per escludere il prelievo di reni irreparabilmente compromessi. La scelta del ricevente in questo caso avviene in base alla compatibilità di gruppo sanguigno e all'esame degli antigeni leucocitari. È così possibile effettuare il trapianto da cadavere in combinazioni biologiche donatore-ricevente più favorevoli.
Esistono attualmente sia in Europa sia negli Stati Uniti organizzazioni che si occupano della raccolta dei dati immunogenetici dei potenziali riceventi di trapianto renale in dialisi. Fra le più importanti citiamo l'Eurotransplant (Olanda, Belgio e Germania), lo Skandia Transplant (Norvegia, Danimarca, Svezia e Finlandia), il France Transplant, l'organizzazione britannica U.K. Transplant e infine, per quanto riguarda l'Italia, il Nord Italia Transplant e l'Italia Transplant Centro-Sud. Attraverso queste organizzazioni è possibile realizzare lo spostamento del rene dal centro dove giace il donatore cadavere a quello dove aspetta il ricevente più istocompatibile. La scelta avviene mediante l'impiego di un elaboratore elettronico che seleziona i riceventi più compatibili in particolari elenchi (v. tab. IX).
Sono stati effettuati scambi di organo anche da un continente all'altro con buoni risultati. Reni provenienti da New York e da Chicago, mantenuti in perfusione per oltre 48 ore, sono stati trapiantati con successo a Roma. Altri reni sono stati inviati dagli Stati Uniti in Francia, in Olanda e in Israele. Lo scambio internazionale dei reni al fine di trapianto consente la massima utilizzazione degli organi, la possibilità di fornire reni a pazienti con necessità urgente di trapianto, il reperimento di reni per pazienti presensibilizzati, e infine l'esecuzione di trapianti da donatore cadavere con una compatibilità per 8-10 antigeni HLA e cioè praticamente ideale.
c) Aspetti tecnici.
Il destino di un organo trapiantato viene generalmente tracciato nei primi tre mesi postoperatori. La ‛nascita' di un nuovo organo è il periodo più delicato e, in questa fase, non è ammesso alcun errore né tecnico, né di rianimazione postoperatoria dell'organo.
Il successo del trapianto renale è dovuto a fattori che riguardano inizialmente il donatore e quindi il ricevente. Per questo, il prelievo dell'organo dal vivente esige particolari accorgimenti, come la novocainizzazione del peduncolo vascolare prima della dissezione e la stabilizzazione entro valori normali della pressione arteriosa durante l'intervento. Nel prelievo da cadavere l'organo deve essere prelevato non appena constatata la morte.
Il rene, dopo il distacco dal donatore, deve essere perfuso e raffreddato sino a 7-8 °C: la ripresa funzionale è infatti proporzionale al danno ischemico subito, specie quello a caldo. L'organo viene trapiantato nel ricevente anastomizzando la vena renale alla vena iliaca esterna e l'arteria renale all'arteria ipogastrica. L'uretere di solito viene reimpiantato in vescica. L'intervento viene completato con la nefrectomia bilaterale, se essa non è stata eseguita in precedenza.
d) Decorso postoperatorio e trattamento antirigetto.
Dopo il trapianto, se il donatore è un consanguineo vivente o un cadavere ‛a cuore battente' ed è stato pertanto evitato un prolungato tempo di ischemia dell'organo, il rene funziona in maniera ottimale e si assiste a una completa normalizzazione delle costanti ematochimiche e dei dati clinici. La clearance della creatinina risale in media intorno ai 60-80 ml/min con punte massime di 100-120 ml/min.
Nei casi di trapianto di rene da cadavere con prolungata agonia o con tempo di ischemia superiore alle 12-15 ore, si può avere una necrosi tubulare acuta con oliguria o anuria. In questi casi è necessario sottoporre il paziente a diverse applicazioni emodialitiche in attesa del recupero della funzione renale. Generalmente in due o tre settimane si assiste a una ripresa della funzione renale sufficiente a depurare il malato.
Per quanto riguarda il trattamento farmacologico dei trapianti, esso va condotto controllando soprattutto la funzione renale e il quadro immunologico, in modo da rilevare subito i segni iniziali del rigetto, che consistono prevalentemente in: a) innalzamento della temperatura corporea; b) aumento numerico dei globuli bianchi; c) aumento della pressione arteriosa; d) aumento del BUN (azoto ureico); e) aumento della creatininemia; f) diminuzione della clearance della creatinina; g) diminuzione della diuresi; h) aumento di volume dell'organo trapiantato; i) aumento della reattività immunitaria, rilevato attraverso test immunologici; 1) alterazione del quadro renografico e della scintigrafia morfofunzionale. La presenza di una tale sintomatologia rende necessario un intervento rapido ed efficace per ottenere la regressione della reazione biologica.
Il trattamento correntemente impiegato è quello con ciclosporina al dosaggio di 3-5 mg/kg/die per via endovenosa, sino alla ripresa dell'assorbimento intestinale; successivamente 15 mg/kg/die per os per 15 giorni, quindi il dosaggio viene ridotto di 2 mg/kg/die ogni mese, fino a raggiungere 6-8 mg/kg/die. Alla ciclosporina viene associato metilprednisolone a basso dosaggio (16 mg/die).
In caso di rigetto si somministrano inoltre tre dosi urto (una per giorno) di 500-1.000 mg di metilprednisolone per via endovenosa, poi si riduce rapidamente il trattamento con gli steroidi mantenendo lo stesso dosaggio di ciclosporina. Si eseguono numerosi controlli del livello ematico della ciclosporina e della citologia urinaria e si praticano biopsie renali allo scopo di ottenere l'induzione della tolleranza funzionale con il minimo di effetti collaterali.
e) Complicazioni del trapianto renale.
Oltre al rigetto, una notevole varietà di complicazioni sono state descritte nei pazienti con trapianto renale, le principali delle quali possono essere raggruppate nelle seguenti categorie.
1. Chirurgiche: stenosi arteriose, che possono provocare ipertensione; trombosi dell'arteria renale o della vena renale; emorragia dell'anastomosi; fistole urinarie.
2. Tossicità da azatioprina: intossicazione del midollo osseo sino all'insorgenza di agranulocitosi, trombocitopenia ed epatotossicità.
3. Tossicità da ciclosporina: epato- e nefrotossicità, irsutismo.
4. Effetti collaterali da corticosteroidi: ulcera peptica, che può perforarsi o sanguinare; necrosi asettica ossea con collasso della testa femorale; artriti del gomito e del ginocchio; pancreatiti, ulcere corneali e formazioni di cataratte; inoltre tutte le stimmate della sindrome di Cushing.
5. Infezioni: queste sono una delle principali cause di mortalità nei pazienti sottoposti a trapianto renale e colpiscono i polmoni, le vie urinarie e la ferita chirurgica; le complicanze possono essere drammatiche, se l'infezione interessa le anastomosi vascolari, per la gravità e l'imponenza delle emorragie; la maggior parte delle infezioni è di origine endogena, rare sono le infezioni dall'ambiente esterno, grazie all'isolamento semisterile in cui sono mantenuti i pazienti.
Gli organismi patogeni più frequentemente isolati sono Escherichia coli, Pseudomonas, Klebsiella e Candida albicans. Possono comparire anche peculiari infezioni virali, quali sepsi da Citomegalovirus. Anche vecchie, latenti forme tubercolari possono riacutizzarsi. In altri casi la morte può essere determinata da candidosi invasive delle vie aeree superiori, da aspergillosi o pneumocisti. Nel trattamento delle infezioni di questi pazienti si incontrano numerose difficoltà: i segni delle infezioni sono mascherati dai corticosteroidi, il trattamento dell'infezione sostenuta da un germe frequentemente porta alla comparsa di un'altra infezione, spesso più resistente alla terapia. Ridurre o abolire le infezioni in questi pazienti richiede un'estrema accuratezza di modulazione del trattamento immunosoppressivo, che va mantenuto al minimo dosaggio efficace e talvolta sospeso per consentire il recupero delle difese immunitarie, associando un energico e mirato trattamento antibiotico, in cui devono sempre essere presenti farmaci antimicotici.
f) Risultati.
Il programma dei trapianti renali effettuati dal nostro gruppo è iniziato nel 1966 e da allora ha registrato notevoli progressi con l'aumentare dell'esperienza clinica. La più lunga sopravvivenza funzionale tra i casi da noi operati è quella di un caso di trapianto renale da un cadavere associato a nefrectomia bilaterale; l'organo funziona da oltre 17 anni (marzo 1967) con valori di clearance della creatinina oltre 60/70 ml/min e creatininemia di 1,2-1,4 mg%.
Nel 1983, dopo oltre 400 trapianti renali eseguiti in collaborazione con un centinaio di centri italiani con attivi programmi di emodialisi e di CAPD (Continuous Ambulatory Peritoneal Dialysis), il programma trapianto di rene è stato suddiviso in 6 sottoprogrammi, per consentire una maggiore funzionalità e una più specifica preparazione dei singoli pazienti.
1. I sottoprogramma (SP): trapianto di rene da donatore vivente. - Il trapianto di rene da vivente viene effettuato sia in pazienti in dialisi, sia in pazienti con filtrato glomerulare corrispondente a una clearance della creatinina intorno a 10-12 ml/min. Vengono presi in considerazione riceventi di età compresa tra i 15 e i 50 anni: i riceventi in età inferiore ai 15 anni entrano nel VI SP e quelli oltre i 50 anni nel V SP.
Dopo lo studio clinico e immunologico si effettua un breve pretrattamento con ciclosporina per via endovenosa nei tre giorni precedenti il trapianto. Il donatore può essere sia un consanguineo (genitore, fratello, figlio, cugino, zio, ecc.) sia un non consanguineo (moglie o marito). I prerequi siti necessari sono: a) età biologica che non manifesti segni clinici e strumentali di senescenza; nella nostra esperienza il più anziano donatore aveva 65 anni al momento dell'intervento; b) consenso libero e informato, espresso per iscritto secondo la legge; c) compatibilità ABO e crossmatch negativo con il ricevente. Il trattamento postoperatorio è con ciclosporina a dosaggio individualizzato.
I risultati globali, espressi nella tab. X, ci inducono a considerare pressoché ideale il trapianto da donatore vivente. Nel follow-up di circa un centinaio di donatori, alcuni dei quali hanno superato i 15 anni dalla donazione, non abbiamo constatato deficit funzionali, nè complicanze a distanza attribuibili alla donazione di rene.
2. Il SP: trapianto di rene da cadavere in riceventi non immunizzati. - Il trapianto di rene da cadavere viene effettuato dopo un accurato controllo clinico e immunologico. I pazienti vengono inseriti in una particolare lista di attesa che tiene conto, oltre che delle segnalazioni dei centri dialisi e dei criteri di urgenza Eurotransplant, delle regioni di provenienza, in modo da poter trapiantare reni provenienti dalle regioni del Centro-Sud in pazienti delle stesse regioni. Pazienti di altre città vengono ricoverati in centri clinici di Roma.
Il paziente viene pretrattato per alcune settimane con ciclosporina, al fine di valutare la tolleranza al farmaco, di ridurre il rapporto linfociti helper/suppressor (OKT4/OKT8) a ≤ 1 e di prepararlo psicologicamente all'intervento.
Il trapianto viene effettuato in base alla compatibilità ABO e al crossmatch negativo. I risultati di questo nuovo approccio terapeutico sono riportati nella tab. XI. I pazienti con reni policistici vengono previamente sottoposti a nefrectomia bilaterale. Il pretrattamento con ciclosporina viene iniziato circa 45 giorni dopo la binefrectomia. Analogamente, altri interventi urologici che si rendono necessari vengono eseguiti in precedenza.
Appare evidente da questo programma il ruolo del responsabile del centro dialisi, che contribuisce attivamente alla formazione della lista di attesa, allo studio clinico pretrapianto e al controllo post-trapianto del paziente in trattamento con ciclosporina.
3. III SP: trapianto di rene da donatore cadavere in pazienti immunizzati. - Il trapianto renale viene effettuato in pazienti high responders con elevato titolo di anticorpi citotossici dovuti a: a) pregresso trapianto renale seguito da rigetto ed espianto; b) immunizzazione da gravidanza o da trasfusioni non programmate; c) immunizzazione da trasfusioni di sangue programmate.
Dopo un accurato studio clinico e un monitoraggio immunologico, che prevede un dettagliato studio del livello e della specificità degli anticorpi, i pazienti sono sottoposti a un ciclo di irradiazione linfatica totale, in modo da ottenere una progressiva e stabile riduzione dell'immunità cellulare. Il paziente subisce successivamente il trapianto di un rene compatibile per i gruppi ABO e con crossmatch negativo.
L'intervallo tra la fine della TLI e il trapianto può anche essere di 60-90 giorni, purché venga effettuato un periodico monitoraggio delle sottopopolazioni linfocitarie.
Il paziente nel decorso postoperatorio viene sottoposto a trattamento con ciclosporina. I risultati sono stati finora estremamente positivi, come precedentemente esposto.
4. IV SP: trapianto renale in nefropatici diabetici. - Il trapianto viene effettuato dopo un accurato controllo clinico e ormonometabolico e una completa valutazione immunologica. Nei pazienti con nefropatia diabetica e clearance della creatinina tra 20 e 30 ml/min il trapianto viene effettuato prima del crollo dei valori del filtrato glomerulare, per evitare l'ulteriore aggravamento determinato dall'uremia terminale. Tutti i pazienti vengono pretrattati con un ciclo di TLI. Il trapianto viene effettuato con un rene con compatibilità ABO e crossmatch negativo. Il trattamento post-trapianto si effettua con ciclosporina.
Nel caso di trapianto da donatore vivente la preparazione può prescindere dal trattamento con TLI se il paziente è un low-responder in base ai controlli immunologici associati o meno a DST (Donor Specific Transfusions) e azatioprina. Si tende così a ridurre al minimo eventuali crisi di rigetto postoperatorie. Il trapianto viene eseguito con controllo glicemico continuo mediante Biostator e nel periodo postoperatorio viene applicato un apparato esterno indossabile per la somministrazione controllata di insulina (minunfusore programmato). Il paziente viene sottoposto a completo riesame 6 mesi dopo il trapianto, per un eventuale trapianto segmentario di pancreas. In alcuni casi viene eseguito il trapianto simultaneo di rene e pancreas, se il centro diabetologico o il centro nefrologico che invia il paziente concorda con l'indicazione al trapianto multiviscerale. Si sottolinea l'importanza del trapianto renale precoce in questi pazienti ad alto rischio.
5. V SP: trapianto di rene in ultracinquantenni. - L'esperienza acquisita ci ha consentito di tipizzare un nuovo sottogruppo di nefropatici, quello dei pazienti che hanno superato i 50 anni di età; il più anziano, che aveva 59 anni al momento del trapianto, ha ora superato i 66 anni con un rene perfettamente funzionante.
La possibilità di impiegare la ciclosporina anche in questo gruppo di pazienti apre una via terapeutica negata loro in molti centri trapianto europei. Anche in questo caso, dato che si tratta di pazienti ad alto rischio, le indagini strumentali e cliniche pre-trapianto debbono essere molto accurate e focalizzate soprattutto a livello dell'apparato cardiovascolare.
Il trapianto può essere effettuato da donatore vivente o da cadavere secondo gli usuali criteri di determinazione dello status immunitario e adeguato pretrattamento immunofarmacologico e radiobiologico. La selezione dei pazienti è concordata tra i responsabili del centro nefrologico di riferimento del paziente e i responsabili del programma renale del nostro Centro.
6. VI SP: trapianto renale in età pediatrica. - Viene effettuato dal nostro Centro anche con un nuovo programma, che prevede la collaborazione con l'Ospedale Bambin Gesù di Roma. Infatti la collaborazione di pediatri competenti e di personale paramedico specializzato è di vitale importanza.
Questo programma è in fase iniziale, per cui possiamo solamente anticiparne le linee essenziali: a) programma da donatore vivente, quando possibile, e con riceventi di peso superiore a 30 kg; b) programma da donatore cadavere pediatrico negli altri casi; c) trattamento con ciclosporina.
g) Conclusioni.
Nel Servizio Trapianti d'Organo dell'Università di Roma è stato possibile ottenere negli ultimi anni oltre l'80% di risultati positivi per quanto riguarda l'accettazione del trapianto e il 95% di sopravvivenza dei pazienti, equiparando i risultati del trapianto da donatore cadavere a quelli del trapianto da donatore vivente. Ciò è stato realizzato grazie a un'accurata selezione immunologica e all'impiego di particolari metodiche di controllo del rigetto, come la somministrazione di ciclosporina.
La vita dei pazienti che hanno subito un trapianto con successo è completamente normale. Non sappiamo ancora, al momento attuale, quanto essa possa durare, però i casi sopravvissuti oltre 15 anni dimostrano che questa terapia è altrettanto valida, se non più, di quelle che si impiegano nel trattamento del cancro. Il fatto che un paziente possa essere riabilitato da uno stato di uremia, anche se parzialmente compensato dal trattamento emodialitico, e riportato a una vita pressoché normale giustifica pienamente questa terapia.
5. Il trapianto di fegato.
Le prime esperienze cliniche risalgono agli anni sessanta. Tuttavia, numerosi fattori limitano ancora l'applicazione di questa procedura a pochi centri europei e degli Stati Uniti, che hanno maturato una competenza specifica in questo particolare settore della ‛immunochirurgia'.
Nella nostra esperienza, iniziata nel 1966, abbiamo studiato, in fasi successive, gli aspetti di tecnica chirurgica, la fisiopatologia e i meccanismi di rigetto del trapianto di fegato nel cane e nel maiale e le diverse metodiche di assistenza epatica; più recentemente, a causa del crescente numero di pazienti con cirrosi epatica in fase terminale o neoplasie del fegato multinodulari, in situazioni, cioè, che rendevano inattuabili le terapie mediche o chirurgiche convenzionali, la nostra attenzione è stata focalizzata sulla valutazione dei potenziali riceventi in funzione del trapianto.
Nel maggio 1982 è iniziato presso il nostro Centro il programma clinico con l'esecuzione del primo trapianto di fegato in Italia.
Prenderemo ora in considerazione i principali aspetti che caratterizzano il trapianto di fegato e che comprendono le indicazioni, la tecnica chirurgica e i meccanismi del rigetto, che presenta per questo organo aspetti del tutto particolari.
a) Indicazioni.
Le due principali malattie suscettibili di cura a mezzo di trapianto sono le neoplasie primitive del fegato e la cirrosi epatica (v. tab. XII).
I tumori primitivi del fegato a localizzazione multifocale, per il loro lento accrescimento, la tendenza tardiva a determinare metastasi a distanza, l'impossibilità di attuare una terapia chirurgica convenzionale e la pressoché totale insensibilità alla chemioterapia, costituiscono una indicazione favorevole al trapianto, anche se talvolta è difficile escludere metastasi in sedi diverse dalla primitiva localizzazione epatica.
Non sembra invece giustificato eseguire il trapianto di fegato in caso di neoplasia secondaria, per l'elevato rischio che la neoplasia primitiva sia contemporaneamente diffusa ad altri organi; infatti è improbabile che la localizzazione epatica sia l'unica sede di una disseminazione generalizzata a carattere multifocale.
I processi cirrotici in senso lato costituiscono l'indicazione principale al trapianto di fegato, quando la malattia epatica è in fase terminale e non è presente un severo interessamento degli altri apparati.
Dato che, per quanto riguarda la cirrosi, è notoriamente difficile formulare una diagnosi precoce, l'indicazione deve essere posta solo in seguito a un'attenta valutazione del paziente; tuttavia, bisogna evitare di eseguire il trapianto, come si è verificato in molti casi in passato, quando il paziente è in fase terminale, moribondo, poiché si accresce notevolmente il rischio operatorio e diventa improbabile che il paziente possa superare l'intervento chirurgico.
Attualmente devono essere considerati candidati ideali al trapianto i pazienti cirrotici con varie complicanze emodinamiche e metaboliche concatenate, nei quali la terapia medica o chirurgica ‛per settori' risulta del tutto inefficace. In questi casi la prognosi di vita è sempre inferiore a 6 mesi.
Indicazioni più rare sono rappresentate dall'atresia delle vie biliari e dai disordini congeniti del metabolismo - quali la galattosemia, il deficit di antitripsina e il morbo di Wilson - e da rare forme degenerative suppurative delle vie biliari intraepatiche, come in un caso da noi operato, affetto da morbo di Caroli.
b) Tecnica chirurgica.
1. Prelievo e conservazione del fegato. - Il fegato è un organo estremamente sensibile all'ischemia, soprattutto a caldo. Per tale ragione è preferibile eseguire il prelievo a ‛cuore battente', impiegando come donatori soggetti in morte cerebrale che non abbiano presentato episodi gravi di ipotensione prolungata. L'organo da trapiantare deve essere infatti in condizioni di perfetta vitalità, in modo da poter riprendere la sua funzione immediatamente dopo che le connessioni vascolari con l'organismo ospite siano state ristabilite.
Attualmente viene impiegata come metodo di conservazione la semplice perfusione ipotermica dell'organo attraverso la vena porta e l'arteria epatica con soluzione fredda, seguita da conservazione in ghiaccio. Come liquidi di perfusione si usano soluzioni di tipo intracellulare o una frazione proteica plasmatica avente una concentrazione di albumina del 96%. Con tali metodiche è stato possibile mantenere l'organo perfettamente vitale fino a 12 ore, consentendo lo scambio degli organi fra i vari centri di trapianto europei.
La tecnica chirurgica dell'epatectomia nel donatore può essere schematizzata nelle seguenti fasi: a) incisione cutanea sottocostale bilaterale; b) scheletrizzazione del fegato e di entrambi i reni; c) preparazione dei vasi iliaci e della vena mesenterica superiore; d) eparinizzazione generale e perfusione in situ del fegato e dei reni attraverso l'aorta e la vena mesenterica superiore, eseguendo contemporaneamente la decompressione del sistema vascolare attraverso la vena cava inferiore; quando il fegato è sufficientemente raffreddato (10 °C) si esegue l'epatectomia seguita dalla nefrectomia bilaterale.
Il fegato così prelevato viene posto in un doppio sacchetto sterile contenente soluzione salma a 4 °C e successivamente in un contenitore di polistirolo contenente ghiaccio, per la conservazione e l'eventuale trasporto in altri centri. Tale metodica ha permesso, in un intervento da noi eseguito, di prelevare l'organo a Birmingham (Inghilterra) e di assistere a una ripresa funzionale immediata del fegato trapiantato dopo un periodo di ischemia totale fredda di 12 ore.
2. Reimpianto del fegato. - Il trapianto di fegato può essere eseguito nella stessa sede dell'organo asportato (trapianto ortotopico), oppure in altra sede intraddominale, lasciando in situ il fegato del ricevente (trapianto eterotopico). Tuttavia, anche se apparentemente di facile soluzione, il trapianto eterotopico di fegato, impiegato nel trattamento di alcune forme benigne di epatopatia cronica terminale, ha trovato scarsa applicazione clinica, per il collocamento non sempre agevole del fegato nell'addome e per le numerose complicanze a esso connesse, quali torsioni e trombosi vascolari, che hanno portato frequentemente all'insuccesso completo.
La tecnica chirurgica maggiormente impiegata per il trapianto ortotopico, basata su quella descritta originariamente da Starzl, può essere schematizzata nelle seguenti fasi: a) epatectomia del ricevente secondo la stessa metodica attuata per l'asportazione del fegato del donatore; questa fase può presentare notevoli difficoltà per la presenza di grossi arroccamenti venosi facilmente sanguinanti; b) rivascolarizzazione del trapianto previo declampaggio della vena porta, della vena cava inferiore, sopra- e sottoepatica, dell'arteria epatica precedentemente anastomizzata tra donatore e ricevente; c) completata la rivascolarizzazione dell'organo e ristabilito il ritorno venoso, si esegue la ricostruzione delle vie biliari.
Numerose sono state le tecniche proposte per la ricostruzione delle vie biliari. Attualmente, anche se lungi dall'essere fisiologiche, le metodiche maggiormente impiegate sono rappresentate dalla epaticodigiunostomia (Starzl) e dalla coledoco-coledoco anastomosi con l'interposizione della colecisti. La tecnica da noi impiegata è rappresentata dalla epaticodigiunostomia su ansa alla Roux.
c) Complicanze.
Le complicanze dopo trapianto di fegato, e in special modo quelle chirurgiche e le infezioni, hanno rappresentato nei primi anni di questa chirurgia sostitutiva la principale causa di mortalità postoperatoria precoce. La necrosi epatica massiva, le trombosi vascolari, le fistole e le ostruzioni del drenaggio biliare, le frequenti sepsi localizzate e generalizzate hanno infatti influenzato pesantemente la prognosi del paziente sottoposto a trapianto di fegato. Tuttavia, i notevoli progressi in questo settore, quali la standardizzazione della chirurgia, la possibilità di utilizzare tecniche microchirurgiche per le anastomosi vascolari e biliari (v. chirurgia: Microchirugia ricostruttiva, suppl.) la perfusione dell'albero biliare intra- ed extraepatico durante la fase di conservazione, per evitare la formazione dello sludging biliare, hanno permesso di ridurre al minimo l'incidenza di queste gravi complicanze, quasi sempre mortali.
Per quanto concerne il rigetto, complicanza frequente nel trapianto di altri organi, quali il rene, il pancreas e il cuore, esso sembra presentare in questo caso un andamento del tutto particolare. Nell'esperienza clinica dei due principali gruppi che si sono dedicati al trapianto di fegato (Starzl a Pittsburgh e Calne a Cambridge), il rigetto, sia nella forma iperacuta sia in quella acuta, ha avuto infatti un incidenza nettamente inferiore a quella osservata nel trapianto renale. Tali dati confermano i risultati sperimentali del nostro gruppo, che hanno dimostrato come il rigetto avvenga in modo meno violento nel caso del trapianto di fegato che non nel caso di allotrapianti di cute, rene e cuore.
Nel cane il trattamento con sola azatioprina, limitato a pochi mesi, ha consentito sopravvivenze prolungate senza alcun altro trattamento immunosoppressivo. Inoltre il trapianto di fegato sembra facilitare l'attecchimento dell'allotrapianto di un rene eseguito simultaneamente.
Questi aspetti immunologici potrebbero trovare una spiegazione nel fatto che le cellule epatiche presentano un minor numero di antigeni di superficie e che in coltura sono meno aggredibili da parte di linfociti allogenici. Le cellule di Kupffer e il loro turnover epatico sembrano rivestire altresì una notevole importanza nel rendere il fegato un organo immunologicamente privilegiato. Bisogna tuttavia sottolineare come il rigetto del fegato, una volta instauratosi, evolva molto lentamente e come la terapia immunosoppressiva non influenzi o influenzi molto poco la sua evoluzione. Il rigetto cronico, infatti, insieme alle infezioni secondarie a ripetuti e massivi cicli di terapia immunosoppressiva, rappresenta la principale causa di insuccesso, a distanza di tempo, del trapianto.
d) Risultati.
Il notevole incremento del numero dei trapianti in questo tipo di chirurgia sostitutiva deve essere messo in relazione non solo con la riduzione delle complicanze chirurgiche e delle alterazioni funzionali e organiche, ottenuta grazie a una corretta tecnica di conservazione, ma in modo precipuo con i risultati estremamente incoraggianti raggiunti con l'impiego della ciclosporina come farmaco immunosoppressivo. Ciò ha reso possibile che in alcuni centri, quale quello di Pittsburgh, si siano eseguiti in un anno (1982) 80 trapianti di fegato con una sopravvivenza di un anno di oltre il 70% dei pazienti. Anche nella nostra esperienza la ciclosporina ha consentito di ridurre l'incidenza del rigetto e delle infezioni nel trapianto di fegato, così come nel trapianto di rene e pancreas.
e) Conclusioni.
Da questa rapida rassegna emerge come la quantità degli elementi - concernenti sia la patologia di base sia la situazione immunologica a essa connessa - che devono essere presi in considerazione nel valutare il paziente con patologia epatica ‛benigna' o neoplastica, in funzione del trapianto, sia estremamente elevata.
Per ciò che riguarda la patologia non neoplastica, la presenza degli antigeni Hbs e Delta non costituisce una controindicazione, benché debbano essere prese particolari precauzioni nella scelta del team chirurgico, anche per evitare una eventuale recidiva della malattia. La cirrosi biliare primitiva è una condizione ideale, per la lenta evoluzione della patologia, per le condizioni cliniche del paziente relativamente non compromesse e per la frequente assenza di ipertensione portale grave. La cirrosi biliare secondaria e la colangite sderosante, a causa di numerosi pregressi interventi chirurgici subiti dal paziente (spesso la colangite sderosante si associa a gravi forme di colite ulcerosa che richiedono l'esecuzione di una colectomia totale), possono creare difficoltà chirurgiche durante la fase di epatectomia del ricevente.
In presenza di un tumore del fegato è indispensabile, come affermato precedentemente, confermare che la neoplasia sia primitiva e non di origine secondaria a partenza non facilmente individuabile, come si verifica talvolta per piccoli tumori del colon, del rene e del pancreas.
L'intervento chirurgico di trapianto è ormai pressoché codificato. Utile può essere l'impiego di uno shunt venovenoso tra il distretto dell'emisoma inferiore e quello della vena cava superiore, in caso di instabilità della emodinamica del paziente durante la fase anepatica.
Infine, anche nel caso del trapianto di fegato, l'impiego della ciclosporina ha consentito di incrementarne il numero e di migliorarne significativamente i risultati, così che esso è diventato il trattamento di elezione per i pazienti affetti da patologia epatica in fase terminale.
6. Il trapianto di cuore.
Il primo intervento di trapianto cardiaco è stato eseguito nel dicembre 1967 da Chr. Barnard a Cape Town e da allora sono stati eseguiti oltre 600 interventi: circa 300 pazienti sono viventi, e tra di essi 8 hanno superato il nono anno dal trapianto, 18 il quinto e uno il decimo. Il gruppo chirurgico che ha eseguito il maggior numero di trapianti cardiaci è quello della Stanford University (Palo Alto), che ha portato a termine finora 260 trapianti con una media di uno al mese: 106 di questi pazienti sono attualmente viventi.
a) Indicazioni.
Nell'era iniziale dei trapianti cardiaci non era ancora ben chiaro in quali affezioni fosse indicata la sostituzione del cuore: il numero dei potenziali riceventi era senza dubbio stimato in eccesso e si proponevano dati esagerati. Ora che la procedura del trapianto è molto meglio definita, le indicazioni sono divenute senz'altro più chiare.
Vi sono tre cause principali di insufficienza cardiaca terminale che possono essere suscettibili di trattamento con trapianto di cuore: 1) grave ischemia miocardica da malattia arteriosclerotica coronarica, con esteso, irreversibile danno del muscolo cardiaco: spesso questi pazienti sono già stati sottoposti a by-pass coronarico; è importante escludere pazienti di età superiore ai 50 anni, con diffusa arteriosclerosi; 2) cardiomiopatie sufficientemente gravi da produrre insufficienza cardiaca irreversibile; 3) valvulopatie a carico di più di una valvola, con irrimediabile danno del miocardio e impossibilità di risolvere la cardiopatia tramite sostituzione valvolare.
Riassumendo, il candidato ideale al trapianto di cuore è un soggetto giovane, in buone condizioni generali, con una cardiopatia all'ultimo stadio, che accetta il rischio del trapianto in vista di un notevole miglioramento funzionale; deve presentare un minimo danno secondario degli altri organi e assenza di affezioni sistemiche; è inoltre necessario che abbia un'attitudine ottimistica riguardo all'esito del trapianto, familiari disposti a collaborare e non abbia preoccupazioni di lavoro.
b) Prelievo dal donatore.
Il donatore deve essere un cadavere decerebrato in cui è stata accertata la morte secondo le modalità di legge. L'operazione è sincronizzata con quella del ricevente, così da ridurre al minimo il tempo di ischemia. Il cuore, prelevato in toto, viene raffreddato in ipotermia di superficie immergendolo in soluzione fisiologica a 6-8 °C. Questa metodica di conservazione mantiene l'organo in condizioni ottimali di vitalità per 3-4 ore, consentendone anche il trasferimento per brevi distanze. È comunque preferibile che donatore e ricevente siano nello stesso centro in due camere operatorie contigue.
c) Trapianto ortotopico.
1. Tecnica chirurgica. - La tecnica del trapianto ortotopico, sviluppata da Shumway e Lower negli animali da esperimento, è stata sistematicamente seguita nel trapianto cardiaco clinico. Il ricevente è posto in circolazione extracorporea e il cuore è asportato a livello degli atri lasciando in situ la porzione posteriore e parte delle pareti laterali; l'arteria polmonare e l'aorta vengono sezionate all'origine poco al di sopra dell'impianto della valvola. Le pareti atriali vengono successivamente connesse con una sutura continua. Si riconnette l'aorta e si ristabilisce la circolazione coronarica. Anastomizzata l'arteria polmonare, si espelle l'aria dalle cavità cardiache. Non appena il cuore si è riscaldato e compare una valida fibrillazione ventricolare, viene elettricamente defibrillato; talvolta riprende spontaneamente il ritmo sinusale. Man mano che l'attività cardiaca migliora si riduce gradualmente il flusso della circolazione extracorporea, sino a che il nuovo cuore sostiene completamente la circolazione.
2. Decorso postoperatorio e trattamento del rigetto. - Ogni cura dev'essere impiegata per mantenere la funzione cardiaca in condizioni ottimali: isopropilnoradrenalina e cardiocinetici devono essere quasi sempre utilizzati, oltre a dipiridamolo, per prevenire aggregazioni piastriniche. Il trattamento immunosoppressivo è analogo a quello del trapianto renale: ciclosporina, globulina antilinfocitaria e corticosteroidi somministrati in base ai dati del monitoraggio immunologico.
Il rigetto viene diagnosticato in base a dati clinici, elettrocardiografici, istologici e immunologici. I dati clinici consistono in segni di insufficienza del cuore destro, diminuito impulso precordiale, rumore di galoppo diastolico. I segni elettrocardiografici sono una diminuzione di voltaggio del QRS, una deviazione a destra dell'asse elettrico, aritmie atriali e ventricolari con vari gradi di blocco atrioventricolare sino al blocco completo. Biopsie miocardiche, eseguite con uno speciale biotomo per via transvenosa a livello del ventricolo destro, si sono dimostrate particolarmente utili per diagnosticare istologicamente il rigetto prima che la funzione cardiaca fosse deteriorata. Le crisi di rigetto vengono trattate, come descritto in precedenza, con larghe dosi di steroidi e di ALG per via endovenosa. Una grave manifestazione di rigetto è la vasculopatia ostruttiva coronarica, che può provocare un'arteriosclerosi secondaria del cuore trapiantato, soprattutto nei pazienti in precedenza colpiti da coronarosclerosi.
Le complicanze della terapia immunosoppressiva descritte in relazione ai trapianti renali sono presenti anche nei pazienti sottoposti a trapianto di cuore; si riscontra però una maggiore frequenza di infezioni broncopolmonari. Un controllo continuo e accurato dell'apparato respiratorio mediante esami radiologici giornalieri e un'intensa e aggressiva terapia antibiotica hanno consentito di ridurre la frequenza di questa complicanza.
3. Risultati. - È da rilevare che dopo l'iniziale delusione, dovuta senza alcun dubbio all'inesperienza dei gruppi chirurgici che si erano cimentati nel trapianto di cuore, i risultati sono andati progressivamente migliorando, tanto da essere paragonabili a quelli ottenuti nel trapianto renale (v. Griepp, 1979; v. Shumway, 1983). E questo è ancora più rimarchevole, perché nel caso del cuore non ci si può ancora avvalere di un organo artificiale semplice ed efficace come il rene artificiale nel trapianto renale.
Grazie alla totale dedizione e all'eccellente preparazione, i risultati ottenuti dal gruppo chirurgico della Stanford University sono estremamente incoraggianti: in una casistica di 263 trapianti di cuore la sopravvivenza a un anno è dell'80%, a due anni del 74%, a tre anni del 60% e del 50% a quattro e cinque anni. La riabilitazione di questi pazienti con trapianto di cuore è stata notevole: l'85% di essi ha ripreso una normale attività lavorativa. I fattori che hanno consentito un miglioramento così marcato dei risultati sono stati: a) l'impiego della biopsia endomiocardica eseguita mediante uno speciale catetere munito di pinza all'estremità per prelevare un piccolissimo frammento di tessuto cardiaco del ventricolo destro: questa tecnica consente una diagnosi precisa del rigetto cardiaco; b) l'impiego della ciclosporina, che si è dimostrato estremamente efficace; c) la somministrazione di anticoagulanti e antiaggreganti piastrinici per evitare l'arteriosclerosi coronarica del cuore trapiantato; d) il ritrapianto, cioè un secondo trapianto di cuore nei casi di grave, irreversibile rigetto precoce e nei casi di estese lesioni vascolari coronariche da rigetto cronico.
d) Trapianto eterotopico.
1. Tecnica chirurgica. - Il trapianto eterotopico di cuore, come quello ortotopico, è stato eseguito nell'uomo per la prima volta da Barnard nel 1974. La tecnica consiste nel lasciare in situ il cuore originale e nell'anastomizzare la parete posteriore dell'atrio sinistro del nuovo cuore con l'atrio sinistro del ricevente posteriormente al solco interatriale. Questa apertura, che mette in comunicazione i due cuori, è simile per dimensioni a quella dell'orifizio di una normale valvola mitrale. Viene successivamente eseguita un'anastomosi terminolaterale tra l'aorta del donatore e l'aorta ascendente del ricevente. L'arteria polmonare del secondo cuore viene anastomizzata con l'atrio destro del ricevente; in tal modo il secondo cuore assiste il ventricolo sinistro del ricevente.
Se si vuole far funzionare il secondo cuore in modo che assista anche il ventricolo destro, si esegue un'anastomosi tra l'atrio destro del donatore e l'atrio destro del ricevente alla base dello sbocco della vena cava superiore. Con l'impiego di un segmento dell'aorta discendente del donatore per allungare l'arteria polmonare, quest'ultima può essere anastomizzata all'arteria polmonare del ricevente. In tal modo il secondo cuore assiste o sostituisce completamente il vecchio cuore malato.
2. Risultati. - Il trapianto eterotopico di cuore sembra avere, almeno teoricamente, numerosi vantaggi sul trapianto ortotopico. Le funzioni del cuore destro e del cuore sinistro del ricevente sono mantenute, anche se estremamente ridotte, tanto da richiedere un trapianto cardiaco. In caso di rigetto è possibile asportare il cuore trapiantato e procedere a un eventuale ritrapianto di cuore, che può essere effettuato anche a distanza di tempo dalla rimozione del cuore rigettato, in quanto esiste una funzione cardiaca residua del vecchio cuore. Sulla base delle ricerche sperimentali e dei primi dati clinici (v. Losman e altri, 1981), gli svantaggi legati a una riduzione della capacità vitale respiratoria per la presenza del secondo cuore non sembrano molto marcati.
I casi sinora sottoposti a trapianto di cuore eterotopico non sono ancora numerosi, ma i risultati sembrano incoraggianti. È indubbio che dal punto di vista teorico questa tecnica è assai promettente. Nei prossimi anni la maggiore esperienza clinica ci permetterà di effettuare un confronto più valido con la tecnica del trapianto ortotopico.
e) Conclusioni.
Le considerazioni critiche che si possono trarre dall'esperienza di questa epoca pionieristica dei trapianti cardiaci possono essere sintetizzate nel modo seguente: 1) il trapianto cardiaco è possibile nell'uomo, operando con una tecnica precisa e rigorosa; 2) la vita di un soggetto con un cuore trapiantato indenne da rigetto è pressoché normale e sono consentiti anche sforzi fisici; 3) si conoscono molti segni precoci del rigetto che è possibile controllare con una terapia mirata e dosando opportunamente i vari farmaci; 4) si sta sperimentando una tecnica di trapianto cardiaco ausiliario eterotopico (doppio cuore, secondo Barnard) che consente di lasciare in situ il cuore malato, mentre il cuore trapiantato, anastomizzato a lato, aiuta la circolazione sanguigna; 5) non si possiede ancora un cuore artificiale che possa sostituire il cuore durante una grave e irreversibile crisi di rigetto, ma le ricerche in questo campo sono molto avanzate e molto promettenti, come dimostrano i risultati ottenuti anche nel nostro laboratorio.
Quale può essere ora l'atteggiamento nei confronti di questo intervento? Dobbiamo aspettare la completa soluzione dei problemi biologici del rigetto o conviene proseguire con l'esperienza clinica, anche se limitata? Noi riteniamo che la via debba essere duplice: da un lato approfondire con costanza e intensità le ricerche nel settore immunobiologico, dall'altro studiare soprattutto i fenomeni del rigetto nei casi sinora operati ed eseguire un numero ridotto di interventi, solo nei centri con una grande esperienza sperimentale e di ricerca, in casi altrimenti candidati alla morte a breve scadenza, non passibili di altra terapia medica o chirurgica e con la migliore istocompatibilità nei riguardi del donatore.
Infine le ricerche condotte nel settore del cuore artificiale contribuiranno anch'esse alla soluzione del problema della sostituzione cardiaca. (V. anche chirurgia: Cardiochirurgia, suppl.).
7. Il trapianto di pancreas.
Il problema del trapianto del pancreas è stato per molti anni oggetto di una serie di investigazioni sull'animale da esperimento. Sulla base di incoraggianti risultati sperimentali, il gruppo del Dipartimento di Chirurgia dell'Università di Minneapolis ha eseguito una prima serie di quattro trapianti di pancreas nell'uomo nel 1967. L'intervento è stato eseguito in pazienti affetti da diabete giovanile complicato da nefrosclerosi e insufficienza renale. Al trapianto di pancreas è stato pertanto associato il trapianto di un rene. Gli organi sono stati prelevati da cadavere: il rene è stato trapiantato secondo la tecnica usuale in fossa iliaca destra, mentre il pancreas, asportato in blocco con il duodeno, è stato reimpiantato in fossa iliaca sinistra. La rivascolarizzazione è stata ristabilita anastomizzando un segmento di aorta con l'origine del tripode celiaco all'arteria iliaca comune. Il moncone prossimale del duodeno è stato suturato, mentre il moncone distale è stato abboccato alla parete addominale. La funzione endocrina del trapianto è stata apprezzabile nel decorso postoperatorio; essa si è ridotta durante le crisi di rigetto, per migliorare progressivamente man mano che la reazione biologica regrediva. È stata controllata anche la secrezione esocrina del pancreas e si è così verificato che dall'ileostomia fuorusciva abbondante quantità di succo pancreatico ricco in amilasi e contenente tripsina e lipasi.
In successivi trapianti non è stato praticato più l'abboccamento alla parete addominale, bensì il duodeno è stato ricollegato a un'ansa intestinale.
Un'altra tecnica di trapianto pancreatico consiste nell'innestare il corpo del pancreas in fossa iliaca. L'arteria celiaca e la vena porta sono anastomizzate ai vasi iliaci in modo analogo a quanto si fa per il trapianto renale. Il dotto pancreatico è suturato all'uretere del ricevente. Sorprendentemente, questo non comporta alcuna complicanza a carico delle vie urinarie, perché gli enzimi non sono attivati nel loro passaggio in vescica.
Una recente tecnica, messa a punto dal gruppo di Lione (Dubernard), consiste nella preparazione del corpo e della coda del pancreas vascolarizzati dall'arteria e dalla vena spleniche. Il dotto principale pancreatico viene incannulato e iniettato con neoprene per eliminare la funzione esocrina della ghiandola. Il pancreas viene successivamente reimpiantato in fossa iliaca anastomizzando i vasi splenici ai vasi iliaci esterni.
Il trattamento immunosoppressivo è stato condotto con azatioprina e prednisolone, praticando anche irradiazione locale con 60Co (150 rad a giorni alterni per 3 volte). La sopravvivenza massima è stata di 4 anni e 2 mesi su 57 trapianti eseguiti.
Questa tecnica è stata utilizzata per la prima volta in Italia presso il Servizio Trapianti d'Organo dell'Università di Roma trapiantando il rene in fossa iliaca sinistra e il pancreas in fossa iliaca destra in un paziente affetto da diabete giovanile insulino-dipendente con insufficienza renale. Il nostro gruppo ha iniziato l'attività clinica in questo settore della chirurgia sostitutiva nell'aprile 1981. Attualmente la nostra lista di attesa comprende due categorie di pazienti. Il primo gruppo è rappresentato da pazienti con nefropatia diabetica in fase di uremia terminale, nei quali si esegue il trapianto di rene e, contemporaneamente o in una fase immediatamente successiva, il trapianto di pancreas, per evitare la recidiva della complicanza renale, legata alla patologia di base, nell'organo trapiantato. Infatti, né il trattamento emodialitico, nè la dialisi peritoneale continua sono in grado di assicurare al paziente una sopravvivenza a distanza e una buona riabilitazione, tale da consentire il reinserimento del paziente nella vita sociale. Il secondo gruppo comprende invece pazienti con nefropatia diabetica in fase evolutiva, associata o non alle altre complicanze micro- e macroangiopatiche, nei quali la lunga storia della malattia, la grave proteinuria e la marcata riduzione della filtrazione glomerulare fanno prevedere una rapida progressione verso l'insufficienza renale irreversibile. In questi casi il trapianto di pancreas ha lo scopo di bloccare l'evolutività della malattia mediante un controllo ormono-metabolico ottimale del paziente. Numerose ricerche sperimentali e le prime applicazioni cliniche hanno infatti dimostrato la possibilità di una regressione totale o parziale della lesione renale a distanza di tempo dal trapianto.
Per quanto concerne infine la tecnica chirurgica del trapianto di pancreas, consideriamo del tutto non traumatizzante per questa categoria di pazienti ad alto rischio l'impianto dell'organo in fossa iliaca per via extraperitoneale e il blocco della secrezione esocrina mediante l'occlusione del dotto di Wirsung con sostanze, quali il Latex, che determinano una progressiva fibrosi del pancreas esocrino. I controlli ormono-metabolici a distanza dimostrano la buona funzionalità del pancreas endocrino. L'esame istologico del pancreas trapiantato ha mostrato una buona conservazione delle isole di Langerhans, ricche di granulazioni beta. I test di funzionalità endocrina del pancreas avevano anche essi dimostrato l'attività della ghiandola trapiantata.
Questi primi risultati possono in complesso essere considerati relativamente positivi, considerando la fragilità della ghiandola, facilmente esposta a fenomeni di pancreatite acuta. La tecnica del trapianto, però, non appare ancora soddisfacente, mentre dal punto di vista immunologico non sembra sussistano complessi problemi da risolvere.
Attualmente si sta sperimentando la tecnica di preparare isole di Langerhans da pancreas umani e di iniettarle nella vena porta in modo che colonizzino nel fegato e in altri organi e producano insulina. Sono stati effettuati alcuni di questi innesti nell'uomo, dopo che era stata messa a punto la tecnica sull'animale. Si trattava di soggetti sottoposti a trapianto renale per nefropatia dovuta a una grave forma di diabete: in questi casi è stato possibile temporaneamente sospendere il trattamento insulinico. Il rigetto delle isole di Langerhans trapiantate è stato pressoché costante, nonostante il trattamento immunosoppressivo, cosicché si è reso indispensabile riprendere la terapia insulinica. Sono state anche impiegate isole prelevate da pancreas fetali, che sembrano essere meglio accettate.
Le ricerche sul trapianto di pancreas in toto o di isole pancreatiche sono in continua evoluzione e rappresentano un campo di estremo interesse scientifico e sociale per la diffusione e la gravità di talune forme di diabete.
8. Il trapianto di altri organi.
Per quanto riguarda il trapianto dell'intestino e del polmone, si sono eseguiti sporadici interventi ancora nella fase della pura investigazione clinica. I risultati migliori sono stati ottenuti nel trapianto del polmone, in cui si è avuto un caso di sopravvivenza del paziente trapiantato sino a 10 mesi. Migliori risultati si sono ottenuti nei primi trapianti di cuore e polmoni.
9. Il trapianto di cervello.
Nonostante che il trapianto di questo organo presenti, allo stato attuale delle conoscenze, difficoltà di ordine tecnico, fisiopatologico ed etico-sociale pressoché insormontabili, sul terreno sperimentale si sono mossi i primi passi nel tentativo di esplorare quest'area di ricerca.
Il cervello, non avendo un sistema linfatico paragonabile a quello degli altri organi, ma godendo di un'unica circolazione caratterizzata da una specifica barriera ematoencefalica, appare come un settore immunobiologicamente privilegiato per ciò che riguarda il fenomeno del rigetto, secondo solamente alla camera anteriore dell'occhio. Stimolati da queste possibilità, alcuni ricercatori hanno affrontato i diversi e complessi problemi del trapianto cerebrale iniziando dallo studio della conservazione isolata di questo organo, che rappresenta la prima fase di un trapianto. White e altri (1963-1966), a Cleveland, hanno messo a punto una tecnica che permette di isolare completamente la circolazione cerebrale nel cane e nella scimmia, di preparare il cervello mantenendolo irrorato di sangue e di riconnetterlo a una macchina cuore-polmone artificiale che provveda all'ossigenazione e alla circolazione ematica nell'organo isolato. In tal modo è stato possibile mantenere perfettamente vitale per parecchie ore un cervello isolato di animale. La vitalità dell'organo è stata dimostrata in base all'attività elettroencefalografica e allo studio del metabolismo.
Successivamente lo stesso autore ha impiantato al collo un cervello isolato di cane, anastomizzandolo alla circolazione carotido-giugulare. L'organo è stato studiato durante periodi di tempo variabili da poche ore a tre giorni: il parametro funzionale più indicativo è stato l'elettroencefalogramma. Il trapianto ha cessato di funzionare generalmente per cause vascolari. Accurati esami istologici dell'organo trapiantato non hanno messo in evidenza infiltrati cellulari a livello perivascolare o del tessuto nervoso, nè altri aspetti patologici riportabili a fenomeni di rigetto. Le ricerche sul trapianto cerebrale stanno ora proseguendo intensamente; gli esperimenti vengono condotti sul cervello isolato di scimmia, che è una preparazione più semplice di quella di cane. I programmi di ricerca dovranno essere impostati in modo da risolvere i problemi tecnici di anastomosi vascolari per il trapianto, dapprima in sede eterotopica (addominale o cervicale) e successivamente ortotopica. Le conoscenze di immunogenetica e di primatologia già acquisite saranno estremamente utili per programmare una serie di ricerche a livello dei primati subumani. Tuttavia, riteniamo che ancora per diversi anni tali studi si manterranno nell'ambito della pura sperimentazione animale, anche se forniranno sicuramente dati di estrema importanza per la conoscenza dei fenomeni autoimmunitari a livello del sistema nervoso centrale, particolarmente interessanti per le correlazioni che si potranno stabilire con alcune forme della patologia neurologica dell'uomo. Sulla base di queste ricerche sarà forse possibile in futuro programmare un trapianto ipotalamico-pituitario per realizzare una sostituzione permanente neuroendocrina nell'uomo. Comunque le reali possibilità del trapianto di tessuto cerebrale per riparazioni funzionali rimangono attualmente allo stato di pura speculazione teorica.
10. Prospettive dei trapianti d'organo.
La chirurgia dei trapianti d'organo, dopo lunghi anni di ricerche sperimentali, sta entrando in una fase in cui le applicazioni cliniche divengono sempre più numerose. Tale sviluppo è stato conseguito soprattutto mediante una collaborazione interdisciplinare che ha riunito laboratori di immunologia, genetica, farmacologia e chirurgia sperimentale.
Molte branche della medicina potranno in un immediato futuro avvalersi di queste ricerche, non ultimo lo studio dei tumori, che per alcuni aspetti possono essere considerati dei trapianti spontanei.
La tecnica chirurgica dei trapianti è pressoché perfetta per molti organi, quali il rene, il fegato, il cuore, il polmone, il midollo osseo. È in via di elaborazione la tecnica del trapianto di pancreas, del trapianto simultaneo di cuore e polmoni, del trapianto di intestino e di milza. Si sta inoltre studiando la tecnica del trapianto della laringe.
È pertanto possibile trarre delle considerazioni generali sul problema dei trapianti e formulare delle soluzioni prospettiche, inquadrando infine tutto l'argomento sotto una visuale etico-giuridica.
Per quanto riguarda il problema biologico, l'attuale tecnica di tipizzazione consente: 1) la selezione dei fratelli identici nell'ambito dei donatori viventi consanguinei; questi trapianti hanno infatti una prognosi estremamente favorevole, pressoché sovrapponibile a quella dei trapianti fra gemelli; 2) l'esecuzione del trapianto impiegando metodiche di manipolazione immunologica (irradiazione linfatica totale ecc.) nei casi con immunizzazione da trasfusioni o da gravidanze; 3) la creazione di un registro nazionale memorizzato in un elaboratore centrale che raccolga tutti i dati dei potenziali riceventi di trapianto, in modo da distribuire gli organi di cadavere ai pazienti più compatibili da un punto di vista biologico; tale organizzazione si è già estesa in campo internazionale, tanto da creare, tramite opportuni collegamenti, una rete di scambi estremamente efficiente.
Da queste premesse risultano chiare le conseguenze seguenti: 1) gli interventi di trapianto per i vari organi (rene, cuore, pancreas, fegato, polmone) possono ritenersi perfettamente effettuabili; tali operazioni devono però essere eseguite in centri altamente qualificati, dotati di una completa organizzazione tecnico-sanitaria e in cui siano state eseguite approfondite indagini sperimentali; 2) gli interventi per trapianto presentano lo stesso rischio operatorio delle complesse operazioni addominali o di quelle a cuore aperto; la prognosi a distanza può essere paragonata a quella degli interventi palliativi per neoplasie maligne; la sopravvivenza a distanza è destinata a migliorare con il progredire dell'esperienza, come si è verificato nel caso del trapianto renale; 3) un trapianto da cadavere è perfettamente giustificato quando sia stata accertata la morte del donatore: esistono numerosi parametri che consentono di stabilire con certezza l'irrecuperabilità di una lesione cerebrale; 4) quando si decide un intervento di trapianto di cuore, di fegato o di polmone, si è sempre in presenza di malati che non possono più giovarsi di alcun tipo di terapia medica e sono quindi irrimediabilmente condannati a sicura fine; esiste pertanto, con il consenso del paziente, la piena giustificazione a eseguire questi interventi.
Le prospettive future riguardano soprattutto la disponibilità di organi da trapiantare. A questo proposito due soluzioni sono possibili, ambedue a sviluppo parallelo e non antagonistico: 1) un progresso nella conservazione degli organi, tale da consentire l'immagazzinamento di ogni organo trapiantabile, prelevato da cadavere; oggi un organo può essere conservato vitale per 72 ore al massimo: un ulteriore perfezionamento delle tecniche criobiologiche consentirà di mantenere pressoché indefinitamente un organo; 2) l'eterotrapianto e lo xenotrapianto da animale a uomo consentiranno ancor più larghe disponibilità di organi.
Bibliografia.
Barnard, C.N., Heterotopic versus orthotopic heart transplantation, in ‟Transplantation proceedings", 1976, VIII, pp. 15-19.
Baumgartner, W. A., Infection in cardiac transplantation, in ‟Heart transplantation", 1983, III, pp. 75-80.
Borel, J. F., Fevier, C., Gubler, H.V., Biological effects of cyclosporin A. A new antilymphocytic agent, in ‟Agents and actions", 1983, VI, pp. 468-475.
Calne, R. Y., A new technique for biliary drainage in orthotopic liver transplantation utilizing the gall bladder as a pedicle graft conduct between the donor and recipient common bile duct, in ‟Annals of surgery", 1976, CLXXXIV, pp. 605-609.
Calne, R. Y., White, D. J. G. e altri, Cyclosporin. A in cadaveric organ transplantation, in ‟British medical journal", 1981, CCLXXXII, pp. 934-939.
Cochrum, K.C., Histocompatibility typing in renal transplantation, in ‟Renal transplantation and dialysis", 1980, XXXIII, pp. 197-202.
Cochrum, K.C., Hanes, D., Porter, H., Iwaki, Y., Opelz, G., Terasaki, P., Feduska, N., Salvatierra, O., Improved graft survival following donor-specific blood transfusion, in ‟Transplantation proceedings", 1981, XIII, pp. 1675-1678.
Cortesini, R., Clinical transplantation, in ‟Transplantation proceedings", 1979, XI, pp. 1195-1197.
Cortesini, R., Cucchiara, G., Famulari, A., Alfani, D., Bevilacqua, S., Perspectives of heart substitution: temporary implantation of artificial heart followed by heart allograft, in ‟Transplantation proceedings", 1977, IX, pp. 305-307.
Cortesini, R., Renna Molajoni, E., Nuove prospettive nella terapia immunosoppressiva nel trapianto renale, in ‟EOS", 1982, II, pp. 41-45.
Cortesini, R., Renna Molajoni, E., Marinucci, G., Capua, A., Pretagostini, R., Alfani, D., L'irradiazione linfatica totale nei trapianti d'organo: risultati preliminari, in ‟Folia allergologica et immunologica clinica", 1982, XXIX, 6, pp. 512-520.
Cosimi, A. B., Burton, R. C., Calvin, R. B., Hansen, W. P., Goldstein, G., Immunological monitoring and immunosuppression with monoclonal antibodies to human T-cell subsets, in Transplantation and clinical immunology, vol. XIII, Amsterdam 1981, pp. 234-237.
Dickermann, R. M., Twiesa, M.W., Crudup, J. W., Turcotté, J. C., Transplantation of the pancreas into a retroperitoneal jejunal loop, in ‟American journal of surgery", 1975, CXXIX, pp. 48-54.
Dubernard, J. M., Martin, X., Faure, J. L., Devonec, M., Blanc-Brunat, N., Traeger, J., Effect of intraductal injection of neoprene on the canine pancreas, in ‟Transplantation proceedings", 1980, XII, suppl. 2, pp. 123-125.
Dubernard, J. M., Traeger, J., Martin, X., Faure, J. L., Devonec, M., Pancreatic transplantation in man: surgical techniques and complications, in ‟Transplantation proceedings", 1980, XII, 4, suppl. 2, pp. 40-43.
Dubernard, J. M., Traeger, J., Neyra, P., Touraine, J. L., Tranchant, D., Blanc-Brunat, N., A new method of preparation of segmental pancreatic grafts for transplantation. Trial in dogs and in man, in ‟Surgery", 1978, LXXXIV, 5, pp. 633-638.
European Multicenter Trial, Cyclosporin A as sole immunosuppressive agent in recipients of kidney allografts from cadaver donors, in ‟Lancet", 1982, II, pp. 57-63.
Griepp, R. B., A decade of human heart transplantation, in ‟Transplantation proceedings", 1979, XI, pp. 285-292.
Iglehart, J. K., Transplantation: the problem of limited resources, in ‟New England journal of medicine", 1983, CCCIX, pp. 123-128.
Land, W., Gebhardt, Ch., Gall, F. P., Weitz, H., Gokel, M. J., Stolte, M., Pancreatic duct obstruction with prolamine solution, in ‟Transplantation proceedings", 1980, XII, 4, suppl. 2, pp. 72-75.
Losman, J. G., Campbell, C. D., Reploge, R. L., The advantage of heterotopic cardiac transplantation: critical review of the initial results, in ‟Heart transplantation", 1981, I, pp. 53-62.
McMaster, P., Calne, R. Y., Gibby, O. M., Evans, D.B., Pancreatic transplantation in man, in ‟Transplantation proceedings", 1980, XII, 4, suppl. 2, pp. 58-61.
Merrill, J. P., Murray, J. E., Harrison, J. H., Guild, W. R., Successfull homotransplantation of human kidney between identical twins, in ‟Journal of the American Medical Association", 1956, CLX, pp. 277-283.
Najarian, J. S., Sutherland, B. E. R., Ferguson, R. M., Simmons, R. M., Kersey, J., Mauer, S. M., Slavin, S., Kim, T. H., Total lymphoid irradiation and kidney transplantation: a clinical experience, in ‟Transplantation proceedings", 1981, XIII, pp. 417-424.
Persijin, G. G., Gabb, B. W., Van Leeven, A., Notgegaall, A., Hoogebooni, J., Van Rood, J. J., Matching for HLA antigens of A, B and DR loci in renal transplantation, in ‟Lancet", 1978, II, pp. 1278-1280.
Reitz, B. A., Heart-lung transplantation: a review, in ‟Heart transplantation", 1982, I, pp. 291-293.
Reitz, B.A., Pennock, J. L., Shumway, N. E., Simplified operative method for heart and lung transplantation, in ‟Journal of surgical research", 1981, XXXI, pp. 1-5.
Renna-Molajoni, E., Alfani, D., Barnaba, V., Bachtoni, A., Levrero, M., Cinti, P., Cortesini, R., Pre-transplant total lymphoid irradiation (TLI) in kidney transplant, in ‟Proceedings of transplantation and clinical immunology", 1982, XIV, pp. 281-282.
Renna Molajoni, E., Barnaba, V., Cinti, P., Ruocco, G., Bachetoni, A., Alfani, D., Cortesini, R., Monoclonal antibodies in monitoring T cell subsets in patients treated with total lymphoid irradiation (TLI), in International symposium on monoclonal antibodies, Venezia 1982, pp. 60-61.
Renna Molajoni, E., Paciucci, P. A., Monari, C., Cortesini, R., Ricerche preliminari per un monitoraggio immunologico nei trapianti renali, in ‟Atti della Società Italiana Trapianti d'Organo", 1974, VII, pp. 111-119.
Rosenthal, I. T., Shaw, B. W., Hardesty, L., Griffith, B. P., Starlz, T. E., Makaba, T. R., Principles of multipleorgan procurement from cadaver donors, in ‟Annals of surgery", 1983, CXCVIII, pp. 617-621.
Schroeder, S. J., Hemodynamic performance of the human transplanted heart, in ‟Transplantation proceedings", 1979, XI, pp. 304-308.
Shumway, N. E., Cardiac replacement in perspective, in ‟Heart transplantation", 1983, III, pp. 3-5.
Slavin, S., Strober, S., Fuks, Z., Kaplan, H., Induction of specific tissue transplantation tolerance using fractionated total lymphoid irradiation in adult mice: long term survival of allogenic bone marrow and skin grafts. I., in ‟Journal of experimental medicine", 1977, CXLVI, pp. 34-40.
Starlz, T. E., Iwatsuki, S., Schroter, G.T., Terasaki, P., Porter, K., The use of cyclosporin A and prednisolone in cadaver kidney transplantation, in ‟Surgery, gynecology & obstetrics", 1980, CLI, pp. 17-23.
Starlz, T.E., Klintmalm, G. B. G., Porter, K. A., Iwatsuki, S., Schroeter, G. P. J., Liver transplantation with use of cyclosporin A and prednisolone, in ‟New England journal of medicine", 1981, CLIII, pp. 486-490.
Starlz, T. E., Koep, L. J., Halgrimson, C.G., Hood, J., Schroeter, G. P. J., Porter, K. A., Weil, R., Fifteen years of clinical liver transplantation, in ‟Gastroenterology", 1979, LXXVII, pp. 375-388.
Strober, S., Slavin, S., Gottlieb, M., Zan-Bar, I., King, B., Hope, R. T., Fuks, Z., Grumet, F. C., Kaplan, H.S., Allograft tolerance after total lymphoid irradiation (TLI), in ‟Immunological review", 1979, XLVI, pp. 87-112.
Sutherland, D. E. R., Current status of pancreas transplantation registry statistics and an overview, in ‟Transplantation proceedings", 1983, XV, 1, pp. 1303-1307.
Sutherland, D. R. E., Baumgartner, D., Najarian, J. S., Free intraperitoneal drainage of segmental pancreas grafts: clinical and experimental observations on a technical aspects, in ‟Transplantation proceedings", 1980, XII, 4, suppl. 2, pp. 26-32.
Sutherland, D. E. R., Goetz, F. C., Rynasiewicz, J. J., Najarian, J. S. e altri, Segmental pancreas transplantation from living related and cadaver donors: a clinical experience, in ‟Surgery", 1981, XC, 2, pp. 159-165.
Sutherland, D. E. R., Najarian, J. S., Ferguson, R. M., Simmons, R. M., Kersey, J., Mauer, S. M., Slavin, S., Kim, T. H., Total lymphoid irradiation and kidney transplantation: a clinical experience, in ‟Transplantation proceedings", 1981, XIII, pp. 417-424.
Thomson, M. E., Selection of candidates for cardiac transplantation, in ‟Heart transplantation", 1983, III, pp. 65-69.
Touraine, J.L., Laville, M., Dubernard, J. M., Betuel, H., Revillard, J. P., Traeger, J., Thoracic duct drainage in renal transplantation, in Proceedings of the 8th international congress of nephrology, Basel 1981, pp. 1977-1984.
Van Buren, C. T., Kerman, R. e altri, The cellular target of cyclosporin A. Actions in humans, in ‟Surgery", 1982, XCII, pp. 167-172.
Wall, W. J., Calne, R. Y., Herbertson, B. M., Smith, D. P., Underwood, J., Kostakis, A., Williams, R., Simple hypothermic preservation of transporting human liver long distances for transplantation, in ‟Transplantation", 1977, XXIII, pp. 210-216.
Microchirurgia ricostruttiva di Paolo Santoni-Rugiu
SOMMARIO: 1. Nascita e sviluppo della microchirurgia. □ 2. Lo strumentario: a) il microscopio; b) i microstrumenti; c) i fili di sutura microchirurgici. □ 3. Microchirurgia vascolare: a) principi generali; b) le microanastomosi; c) innesti microvascolari; d) terapie anticoagulanti postoperatorie. □ 4. Applicazioni della microchirurgia vascolare: a) reimpianti; b) lembi liberi; c) altri trapianti liberi microvascolari; d) applicazioni di chirurgia sperimentale. □ 5. Microchirurgia dei nervi periferici: a) cenni anatomici; b) strumentario; c) lesione di nervi periferici; d) indicazioni della microchirurgia dei nervi periferici; e) applicazioni della microchirurgia dei nervi periferici. □ Bibliografia.
1. Nascita e sviluppo della microchirurgia.
La microchirurgia, intesa come chirurgia eseguita con l'ausilio visivo del microscopio, non è scienza nuovissima, in quanto l'uso del microscopio in interventi di particolare delicatezza risale all'ormai lontano 1921, quando Nylén, otoiatra di Uppsala, giovandosi di un microscopio monoculare con modesti ingrandimenti (sino a 15) eseguì riparazioni di fistole labirintiche. Lo stesso autore svedese perfezionò l'applicazione del microscopio usando un binoculare con × 235 e infine Holmgren, maestro di Nylén, adottò un microscopio Zeiss binoculare, assai vicino, come concezione e applicazioni, ai nostri moderni microscopi. Gli otoiatri restarono per alcuni anni gli unici fruitori del nuovo mezzo tecnico, del quale la chirurgia otoiatrica si giovò molto, specie nel trattamento dei tumori intrapetrosi del nervo acustico e dell'otosclerosi.
Fu solo verso il 1950 che altre specialità scoprirono l'utilità dell'ingrandimento ottico in corso di operazioni in cui delicatezza e precisione erano condizioni indispensabili del successo chirurgico. In oculistica l'uso del microscopio operatorio, introdotto dall'americano Perrit nel 1946, ha consentito rapidi progressi in numerosi interventi, e già oggi l'italiano Verzella ne prevede l'impiego per il trattamento chirurgico della miopia. Agli inizi degli anni sessanta, con l'estensione delle applicazioni del microscopio operatorio alla chirurgia sperimentale, Jacobson e Suarez, autori di lavori sulla chirurgia dei piccolissimi vasi sanguigni, posero le basi della microchirurgia ricostruttiva. Nel frattempo Smith e Kurze eseguirono le prime riparazioni di nervi periferici con tecniche microchirurgiche, mentre Donaghy e Yasargil applicarono le stesse tecniche alla neurochirurgia.
Tuttavia, solo nel 1965 Bunke e Schulz applicarono le acquisizioni sperimentali di Suarez e Jacobson e nacque così la microchirurgia ricostruttiva. Non sorprende che gli iniziatori di questa nuova branca chirurgica fossero due chirurghi plastici, i cui interventi sono stati sempre caratterizzati da una estrema delicatezza e atraumaticità. Il trattamento di molte delle malformazioni congenite di competenza della chirurgia plastica, così come l'esecuzione di innesti e trapianti di cute e di altri tessuti e anche le operazioni di chirurgia estetica, richiedono una manualità che è concettualmente e tecnicamente simile a quella necessaria in microchirurgia o che, per lo meno, rende il chirurgo plastico più predisposto ad acquisire le tecniche microchirurgiche.
Jacobson e Suarez erano riusciti ad anastomizzare vasi sanguigni del diametro di circa un millimetro, e ciò rendeva possibile il trasferimento di quantità di tessuto anche notevoli da una regione all'altra del corpo consentendo la sopravvivenza e quindi l'attecchimento del tessuto trasferito. Naturalmente, innesti e trapianti di vari tessuti erano già eseguiti in chirurgia da tempo immemorabile; per la loro sopravvivenza e attecchimento, però, era necessario o che avessero uno spessore talmente sottile, come gli innesti di cute, da potersi nutrire per imbibizione delle sostanze diffuse dal letto ricevente sino alla neoformazione di vasi sanguigni attraverso il tessuto della cicatrice fresca, oppure che fossero dotati di vasi nutritizi di un calibro sufficiente all'anastomosi con vasi di egual calibro della regione ricevente. Questo calibro era di norma di alcuni millimetri. L'acquisizione tecnica di Jacobson e Suarez rendeva invece possibile l'apporto nutritizio e quindi la sopravvivenza e l'attecchimento anche di quantità notevoli di tessuto, nonché di organi come dita, testicoli, esofago, ecc., irrorati da vasellini di diametro attorno al millimetro. Purtroppo, però, il numero di successi che anche con l'impiego del microscopio operatorio si riusciva a ottenere non era ancora tale da autorizzare l'applicazione clinica su vasta scala; infatti il numero dei vasellini che andavano incontro a trombosi dopo l'anastomosi, precludendo quindi al tessuto trapiantato l'indispensabile apporto ematico, era ancora troppo elevato. La causa di questa limitazione fu ben presto identificata nello strumentario, troppo grossolano per lavori di tale delicatezza, e soprattutto nei fili di sutura che, per calibro e per tipo di materiale impiegato, producevano sulle pareti del vaso un trauma tale da favorirne la trombosi e determinare quindi il fallimento dell'intervento ricostruttivo. Si doveva arrivare alla fine degli anni sessanta perché molti di questi limiti venissero superati: la fantasia dei costruttori permise il rapido superamento degli ostacoli e agli inizi degli anni settanta esistevano già in commercio strumenti sofisticatissimi ed estremamente atraumatici e fili di sutura con ago atraumatico di calibro sottile (sino a 19 micron) e perfino fili a punta metallizzata in bagno elettrolitico capaci di penetrare le pareti vasali con il minimo trauma possibile.
Nasceva così la microchirurgia ricostruttiva, scienza tuttora in piena evoluzione; a entusiasmi travolgenti seguirono talora amare delusioni, tanto che negli ultimi anni si è giunti a un ridimensionamento delle applicazioni cliniche, che si vanno ora facendo ben determinate e più precise, anche se è forse ancora troppo presto per codificare la materia in limiti scientificamente validi. Attualmente le applicazioni della microchirurgia, oltre a quelle, importantissime, già citate in oculistica e otorinolaringoiatria, interessano molti aspetti della chirurgia ricostruttiva: pertanto la microchirurgia sta entrando nel bagaglio tecnico del chirurgo generale, dell'urologo, dell'angiologo, del chirurgo plastico, dell'ortopedico, del ginecologo e ancora di altri specialisti.
Tessuti come la cute totale, l'osso, l'omento, e organi come dita, intestino, testicoli, pene, sono stati innestati o reimpiantati con tecniche microchirurgiche. Complesse situazioni cliniche in diverse branche chirurgiche sono state brillantemente risolte grazie a queste tecniche che hanno reso possibili ricostruzioni sino a pochi anni fa considerate fantastiche. Ma il campo è ancora in piena evoluzione e difficile sarebbe quindi oggi trattare questo argomento da un punto di vista sistematico. Ci limiteremo quindi a descrivere le tecniche base della microchirurgia ricostruttiva, cioè le anastomosi dei microvasi e le neuroraffie dei fascicoli nervosi, tecniche che sono alla base di ogni intervento di microchirurgia ricostruttiva e che sono ormai consolidate da una esperienza di quasi tre lustri.
Sono queste le tecniche che qualunque chirurgo dovrà padroneggiare se vorrà effettuare con successo operazioni quale il reimpianto di un dito, o i più arditi e complessi interventi ricostruttivi concernenti vari tessuti.
2. Lo strumentario.
Lo strumentario microchirurgico, come già si è accennato, ha rappresentato una delle chiavi dei successi ottenuti negli ultimi anni. Ne tratteremo quindi brevemente, non insistendo mai abbastanza sul fatto che non è possibile acquisire risultati clinicamente e statisticamente validi senza uno strumentario adatto.
a) Il microscopio.
Il microscopio operatorio è uno degli strumenti che sono maggiormente progrediti rispetto al microscopio quasi artigianale usato da Nylén nel 1921. Oggi ne esistono in commercio vari tipi, le cui caratteristiche permettono di soddisfare le diverse esigenze degli specialisti e rendono così più facili le varie ricostruzioni chirurgiche. Esistono microscopi operatori con comandi a mano, e quindi di prezzo relativamente basso, che possono soddisfare perfettamente chirurghi che debbano operare su campi operatori molto ristretti, quale l'occhio; altri, invece, dal costo ovviamente più elevato, sono dotati di sofisticatissimi sistemi di zoom e di fochettatura a pedale e di due e anche tre binoculari, in modo da consentire un lavoro di équipe; a questi microscopi possono essere applicati apparecchi fotografici, cinematografici o di videoregistrazione a scopo documentativo o didattico.
La varietà di questi perfetti microscopi è tale che non ci pare questa la sede adatta a fornirne una descrizione dettagliata, ma è certo che ogni specialista può trovare il tipo di microscopio operatorio più adatto alla sua specialità per caratteristiche tecniche, versatilità, posizione degli oculari, e in grado di favorire al massimo il tipo di interventi in cui deve cimentarsi.
b) I microstrumenti.
L'inventiva dei fabbricanti e degli stessi chirurghi è stata molto stimolata dalla necessità di disporre di strumenti miniaturizzati per la microchirurgia. Alcuni di questi strumenti sono stati, per così dire, presi a prestito da altre arti, come ad esempio le pinzette da orologiaio e da gioielliere, che si adattano benissimo alle necessità atraumatiche e alle manipolazioni microchirurgiche di vasi e di nervi. Altri, invece, come le forbici e i microbisturi, sono stati copiati da altri strumenti già esistenti negli armamentari chirurgici e ridotti convenientemente di misura per adattarli alle esigenze della visione microscopica. Altri infine sono stati ideati ex novo, e tra questi i più importanti sono gli angiostati e i portaaghi, alcuni dei quali, veri capolavori di artigianato, consentono al microchirurgo di operare con leggerezza, maneggevolezza, semplicità, in tal modo favorendo al massimo la manualità chirurgica. Alcuni di questi strumenti sono talmente ingegnosi da riuscire, con un sistema di molle, ad assorbire parzialmente l'energia trasmessa dalle dita dell'operatore minimizzando i movimenti. Gli strumenti devono essere piccoli, dotati di una buona statica nelle manovre manuali, bruniti, onde evitare abbagliamento del chirurgo attraverso le lenti del microscopio, ben equilibrati, perché anche la minima oscillazione verrebbe moltiplicata dall'ingrandimento microscopico e sarebbe quindi incompatibile con la manualità del chirurgo.
I portaaghi sono in genere a molla, mai a scatto fisso, con branche sottili e ricurve; hanno una lunghezza di circa 15 cm, consentono una buona presa tra indice e pollice, e acquistano stabilità riposando sul primo spazio interdigitale e sul dito medio che li sostiene.
Le forbici - rette, curve, smusse, a punta - ripetono in miniatura tutte le varietà, e quindi le applicazioni, di quelle in uso nelle varie specialità chirurgiche, soprattutto in oculistica; sono per lo più dotate di apertura a molla in modo da evitare al chirurgo le manovre di apertura. Infatti, uno degli scopi fondamentali degli strumenti della microchirurgia è quello di ridurre al minimo i movimenti necessari del chirurgo, in modo da diminuire le possibilità che, per un movimento troppo brusco o troppo ampio, lo strumento sia portato fuori dal piccolo campo visivo del microscopio.
Le pinzette, come già accennato, sono in genere usuali pinzette da gioielliere, brunite, rette o curve, di lunghezza in genere inferiore ai 15 cm.
Strumenti essenziali nella microchirurgia dei piccoli vasi sono gli angiostati, la cui realizzazione ha stimolato forse più di qualunque altro strumento la fantasia di chirurghi e artigiani, con risultati mirabili per semplicità ed efficienza. Esiste tutto un armamentario di angiostati a molla, molto delicati, o a vite, molto precisi, in grado di interrompere il flusso ematico e perfino linfatico nei minuscoli vasellini e di approssimare i monconi in modo da facilitare l'apposizione dei punti di sutura senza esercitare trazione, che sarebbe incompatibile con una buona atraumaticità. Gli angiostati sono gli strumenti più importanti nella microchirurgia vascolare e condizionano il successo dell'intero intervento. Gli angiostati a molla o a vite, semplici o doppi, sono adattabili alle diverse esigenze delle singole anastomosi. Tra i moltissimi, tutti con vari pregi, ricordiamo come i più maneggevoli e utili quelli di O'Brien, Gilbert, Henderson. Il chirurgo, qualunque sia l'angiostato scelto per l'anastomosi, dovrà applicarlo con estrema delicatezza in modo da non traumatizzare le esili pareti dei vasi. La pressione di presa sarà sufficiente a interrompere il flusso ematico e a esercitare una certa trazione per l'avvicinamento dei monconi, ma non tale da schiacciare le pareti del vaso stesso, ed è quindi ovvio che l'applicazione dello strumento deve essere sempre eseguita sotto diretta visione microscopica.
Il microcoagulatore bipolare, strumento indispensabile in microchirurgia, consente la coagulazione di microvasi solo nello spazio compreso tra le branche della sua apposita pinzetta, senza il rischio, insito nei normali elettrodiatermocoagulatori, che la coagulazione del sangue si estenda a vasi in continuità con quello che si deve coagulare.
Nella microchirurgia dei nervi periferici è indispensabile l'uso di un neurostimolatore elettrico, che consente l'individuazione anche dei più minuscoli rami nervosi motori: ne esistono vari tipi, tutti ottimi.
Piccole siringhe munite di microcannule di silicone sono indispensabili per il lavaggio dei monconi dei vasi e anche per l'irrorazione del campo operatorio, in quanto alcune fasi delle anastomosi si eseguono meglio se i monconi del vaso, particolarmente delle vene, sono sommersi. Altre volte invece è utile avere il campo operatorio microscopico asciutto: ad esempio nella sutura di fascicoli nervosi; sono allora utili le piccole spugne di cellulosa, ad alto assorbimento - simili in tutto a quelle in uso in odontoiatria - e i microaspiratori.
c) I fili di sutura microchirurgici.
La qualità e il calibro dei fili di sutura hanno rappresentato per lungo tempo il limite all'applicabilità clinica e alla diffusione della microchirurgia. Oggi invece il microchirurgo ha a disposizione una vasta gamma di fili in diverso materiale e di calibri svariati. I più diffusi sono certamente i fili di nylon o di prolene 8/0, 9/0, 10/0 e 11/0.
Anche le caratteristiche dell'ago devono essere ritenute determinanti nella scelta, perché solo con un ago adatto al tipo di sutura da eseguire e alla posizione dei monconi vasali o nervosi, rispetto alla posizione dell'operatore, sarà possibile applicare i punti di sutura con il minimo trauma possibile. Degli aghi sarà importante valutare anche la curvatura e il calibro. Nella microchirurgia dei piccoli vasi è importante che la discrepanza tra calibro dell'ago e calibro del filo sia minima. In genere gli aghi hanno un calibro di circa 60 micron mentre quello del filo si aggira attorno ai 20 micron. Si è già accennato a particolari fili di nylon con l'estremità metallizzata in idrolisi, particolarmente delicati e pertanto usati nella delicatissima chirurgia dei vasi linfatici. Anche la curvatura dell'ago ha la sua influenza sulla facilità dell'apposizione dei punti: in chirurgia vascolare una curvatura considerata ottimale è quella di 3/8 di circolo. Fili e aghi simili sono utilizzati anche nella microchirurgia dei fascicoli nervosi.
3. Microchirurgia vascolare.
Come abbiamo già avuto occasione di dire, la microchirurgia vascolare ha fornito ai chirurghi i mezzi tecnici per eseguire numerosi interventi ricostruttivi in varie specialità chirurgiche. Le applicazioni più frequenti sono forse quelle di competenza del chirurgo plastico, perché il perfezionamento della tecnica delle anastomosi microvascolari ha reso possibile il trasferimento di ampi lembi di cute o di lembi composti comprendenti vari tessuti per ricostruzioni complesse, i trapianti di omento, di osso, di periostio, il reimpianto di dita amputate e il trapianto di dita del piede pro mano, il reimpianto di mani o di segmenti vari, come avambracci, scalpo, pene, ecc. In chirurgia generale le microanastomosi consentono il trasferimento nella giusta sede scrotale di testicoli ectopici ritenuti in addome, la ricostruzione di esofago con anse intestinali, e perfino il trattamento del linfoedema del braccio, conseguente a mastectomia radicale, con anastomosi venolinfatiche. Le applicazioni in ortopedia sono in parte sovrapponibili a quelle in chirurgia plastica, ma è stato anche possibile trapiantare piccole articolazioni dal piede alla mano, reimpiantare interi arti, eseguire trapianti di estese porzioni vitali di ossa lunghe. In ginecologia le stenosi tubariche possono essere corrette con una tecnica microchirurgica di anastomosi delle tube. Si può ben dire che non vi è limite agli interventi che la fantasia dei microchirurghi va suggerendo. Tutti però hanno il loro punto chiave nelle anastomosi microvascolari, cioè nella possibilità di ristabilire una microcircolazione sia arteriosa sia venosa, indispensabile alla vitalità del tessuto.
Le tecniche basilari sono: a) le anastomosi microvascolari arteriose e venose; b) gli innesti microvascolari pro vena e pro arteria; c) le anastomosi linfovenose, limitatamente al trattamento del linfoedema.
a) Principî generali.
La tecnica della microchirurgia vascolare è talmente delicata che nessun chirurgo può illudersi di mantenere un grado di abilità manuale sufficiente senza un esercizio costante su vasi del calibro di circa un millimetro. Soltanto chi in questo tipo di esercizio riesca a ottenere la pervietà di almeno il 9o% delle anastomosi eseguite può dedicarsi alla microchirurgia clinica, in cui le condizioni tecniche presentano quasi sempre un maggior grado di difficoltà rispetto a quelle della microchirurgia sperimentale.
Ovviamente la microchirurgia vascolare non può da sola garantire il successo dell'intervento. Ad esempio, è ovvio che un reimpianto di dita sarà coronato da successo solo se le dita reimpiantate, oltre a sopravvivere, saranno in grado di funzionare, e quindi è necessario che il chirurgo abbia anche una buona competenza della chirurgia riparativa dei tendini, dello scheletro e, ancora più importante, dei nervi della mano. Lo stesso vale naturalmente per ogni altra specialità chirurgica che impieghi i metodi e le tecniche della microchirurgia.
La perfetta integrità delle pareti dei vasi da anastomizzare è forse il prerequisito fondamentale, prescindendo dal quale l'intervento non può che fallire. Infatti la lesione parietale facilita enormemente la formazione di trombi a livello dell'anastomosi con conseguente occlusione del vaso. La lesione dei vasi può essere determinata da vari fattori, anche non recenti: così, ad esempio, i vasi sanguigni compresi in tessuti precedentemente esposti a irradiazioni sono friabili e fibrosi e quindi mal si prestano a un'anastomosi ideale, per la conseguente facile predisposizione alle trombosi. Vasi decorrenti in regioni sedi di infezioni o infiammazioni croniche presentano pareti fibrose, anelastiche, difficilmente suturabili in condizioni ideali. In caso di traumi recenti, i vasi possono essere anastomizzati solo se si riscontrano soluzioni di continuo nette, come si verifica ad esempio in seguito ad amputazione operata con uno strumento ben affilato e preciso; in tutti gli altri casi, e segnatamente nelle avulsioni, negli strappamenti, negli schiacciamenti, è molto improbabile che le pareti del vaso da anastomizzare non siano state danneggiate. Se l'estensione del danno è limitata a pochissimi centimetri, prossimalmente e distalmente alla linea di rottura, il vaso potrà essere resecato e sostituito da un microinnesto, per lo più di vena, di alcuni centimetri; ma se il danno interessa una vasta porzione del vaso, come avviene negli strappamenti di segmenti di arto, le tonache della parete, in quanto dotate di diversa elasticità e resistenza alla trazione, facilmente divengono scollabili le une dalle altre. In questi casi il danno sarà tale da non consentire il reimpianto microvascolare. L'accurata ispezione microscopica dei monconi dei vasi è quindi sempre doverosa e indispensabile per appurare che le varie tonache vascolari dei monconi da anastomizzare siano integre e che i monconi stessi, al rilascio dei clamps angiostatici, abbiano un sanguinamento normale per quantità e, se trattasi di arteria, per caratteristiche pulsatorie. Il chirurgo che omettesse questa ispezione rigidamente indispensabile sarebbe colpevolmente votato all'insuccesso.
Un principio generale valido in tutti i casi di trapianti di tessuto da una regione del corpo a un'altra è quello della uniformità del calibro dei vasi che debbono essere anastomizzati. Una differenza di calibro, infatti, facilita la produzione di vortici e di gorghi a livello o nelle vicinanze dell'anastomosi, ed è noto che tutto ciò che altera il normale e uniforme flusso ematico predispone alla trombosi; questo rischio è maggiore allorché, per il rallentamento del flusso del sangue da un vaso più piccolo a uno più grande, aumenta la possibilità per gli elementi corpuscolati del sangue, segnatamente per le piastrine, di aggregarsi a formare un trombo. O'Brien sottolinea la necessità di rispettare questo principio e precisa che il flusso da un vaso più grande verso uno più piccolo è meno pericoloso agli effetti della produzione di trombi, purché il calibro del vaso più piccolo non sia inferiore alla metà di quello maggiore. La discrepanza di calibro può in parte essere annullata con artifici tecnici, quale quello di sezionare il moncone del vaso minore a ‛becco di danno' in modo da aumentarne la circonferenza. Ove questo artificio non sia sufficiente a un'agevole anastomosi si può interporre tra i due monconi, maggiore e minore, un innesto di vena che renda la differenza di calibro graduale e quindi tale da non generare vortici e gorghi ematici.
b) Le microanastomosi.
1. Preparazione all'anastomosi. - Per la buona esecuzione dell'anastomosi, che è un intervento in genere lungo e tedioso, il chirurgo si deve porre nelle migliori condizioni possibili. Accurato sarà quindi il posizionamento del microscopio e dei suoi oculari, in modo da assicurare all'operatore e all'assistente la migliore visuale possibile. La posizione del chirurgo deve essere comoda, in modo da non rendere necessari frequenti cambiamenti di posizione con possibile perdita del campo visivo microscopico. Anche la posizione di braccia e mani deve essere comoda, onde evitare tremolii o movimenti superflui, tutti ingigantiti dall'ingrandimento microscopico. Bracciali, sostegni, sgabelli appositi e perfino tavoli speciali sono disponibili in commercio, ma spesso l'uso di cuscinetti o di teli chirurgici, adattati estemporaneamente, risulta più efficace. Lo scopo di tutta questa preparazione deve essere quello di limitare al massimo i movimenti inutili e di rendere quelli necessari il più possibile agevoli e ridotti di ampiezza. Anche la pedaliera dei comandi di zoom e fochettatura deve essere accessibile senza difficoltà.
Altrettanto importante è poi una buona esposizione dei vasi da suturare, che si ottiene in genere con l'apposizione di punti di sutura per divaricare le parti molli: non è possibile infatti all'assistente mantenere un divaricatore chirurgico in posizione immobile per i lunghissimi tempi richiesti dalle anastomosi microchirurgiche.
Prima dell'applicazione delle branche dell'angiostato, specie in casi di traumi, bisogna accertarsi del buon sanguinamento dei monconi: un moncone che non sanguina è con ogni probabilità occluso e ciò impone una ulteriore resezione del vaso sino a raggiungere un sanguinamento normale. Inutile e dannoso è l'uso dei cateteri, che possono, è vero, rimuovere il trombo presente, ma non possono eliminare la causa che primitivamente lo aveva provocato e che fatalmente lo farà riprodurre. I vasi debbono essere sezionati con il minimo trauma indispensabile, e le eventuali parti contuse vanno resecate sino ad arrivare alle pareti sane. A questo punto l'avventizia vasale viene delicatamente stirata verso l'estremità del moncone e resecata con forbice in modo che una piccola porzione del moncone stesso resti priva di avventizia e con la sottostante tonaca muscolare esposta. Occorre poi ispezionare con particolare cura l'intima del vaso, che è la tonaca più interna e quindi a diretto contatto con il sangue, per cui ogni sua lesione, anche microscopica, determina la formazione di un microtrombo capace di ingrandirsi sino all'occlusione del lume. In presenza quindi di lesioni quali fessure, abrasioni, strappi, il tratto di vaso la cui intima è interessata deve essere resecato: infatti i tessuti subintimali, se vengono a contatto con il sangue, scatenano la reazione di aggregazione delle piastrine, che è il primo stadio della formazione del trombo. Dopo la loro preparazione, i monconi vasali debbono essere approssimati mediante la convergenza delle due branche dell'angiostato sino a porre i due lumi assai vicini, onde evitare che i punti di sutura debbano poi esercitare una trazione eccessiva, tale da ledere la parete vasale.
2. Anastomosi arteriosa o venosa. - L'ingrandimento che si usa per un'anastomosi tipica (un vaso del diametro di 1 mm) è tra × 5 e × 10; ingrandimenti maggiori fanno perdere la visione d'assieme e si utilizzano solo in casi particolari o per l'ispezione finale della linea di anastomosi. Prima di iniziare l'anastomosi si pone al disotto del vaso una striscia di plastica corrugata e colorata in giallo o verde, in modo da ottenere un buon contrasto cromatico, che facilita molto la visibilità.
L'anastomosi dei microvasi può essere eseguita in maniera terminoterminale, quando i due monconi vasali vengono anastomizzati in continuità tra loro a pieno canale, o terminolaterale, quando un moncone vasale viene anastomizzato in un'apertura appositamente creata sulla parete di un altro vaso, generalmente più grande. Il primo tipo di anastomosi è da preferirsi, in quanto il sangue vi decorre senza ostacoli e quindi minima è la possibilità che si creino vortici o altre irregolarità di flusso, specie se i due monconi sono di diametro simile. Al contrario, nel caso delle anastomosi terminolaterali, il vaso viene anastomizzato con il vaso ricevente sotto una certa angolatura rispetto all'asse di quest'ultimo, ciò che inevitabilmente crea degli ostacoli a un tranquillo deflusso ematico e quindi aumenta le possibilità di trombosi: pertanto le anastomosi terminolaterali debbono essere eseguite solo in caso di necessità, con la massima accuratezza e meticolosità onde minimizzare i rischi di trombosi. Così, allorchè si debba, ad esempio, eseguire un'anastomosi con una delle arterie principali, in un arto ove l'altra arteria sia stata già, per qualche ragione, sacrificata e quindi non sia più funzionante, l'anastomosi, per preservare la circolazione dell'arto stesso, non potrà che essere terminolaterale.
Dopo aver applicato l'angiostato con branche doppie scorrevoli, queste verranno avvicinate quel tanto da consentire la sutura dei monconi senza operare trazione. Se non è già stata eseguita, a questo punto si inizia la resezione di una piccola porzione di avventizia sui due monconi. L'interno del vaso tra la branca dell'angiostato e il lume beante viene accuratamente quanto delicatamente lavato con soluzione fisiologica eparinata al 10% (1.000 U.I. in 100 ml di soluzione fisiologica), usando una sottile cannula di silicone con una piccola siringa ed evitando di traumatizzare l'intima: con tale manovra ogni residuo di sangue viene delicatamente asportato. Questo lavaggio verrà ripetuto periodicamente durante l'anastomosi, onde evitare il deposito di sangue, che può invadere il lume dall'esterno, o anche solo il depositarsi di fibrina. Durante queste manovre si agirà sempre con molta delicatezza, evitando, ove possibile, di toccare l'intima con le pinzette. Preparati in tal modo i monconi, si inizia la sutura delle pareti vasali: il portaaghi deve essere tenuto come una penna tra indice e pollice e riposare sulla prima commissura. Esso viene afferrato a circa metà dell'arco delle molle, e la punta viene diretta verso la parete anteriore del moncone vasale per passarvi il primo punto di sutura. In questa operazione bisogna cercare di far passare l'ago attraverso la parete in direzione perpendicolare alla superficie esterna, in modo da attraversare la parete secondo il tragitto più breve e quindi apportando ai tessuti il minimo trauma possibile.
L'ago deve penetrare la parete a tutto spessore sino al lume, facendo estrema attenzione a che la punta non abbia a ledere l'intima del versante opposto. Estratto l'ago dal lume, lo si farà penetrare, sempre perpendicolarmente, nel moncone opposto, dal lume verso l'esterno e in un punto della circonferenza che corrisponda a quello nel quale lo si è fatto penetrare nel primo moncone. La distanza tra punto di penetrazione dell'ago e margine del moncone deve essere pari allo spessore del vaso stesso, quindi sarà alquanto maggiore nelle arteriole che nelle venule. Passato l'ago attraverso le pareti dei due monconi, si farà scorrere il filo fino a che la sua estremità non apparirà nel campo del microscopio. L'ago deve quindi essere poggiato in un punto morto del campo visivo microscopico facendo attenzione che, nelle manovre di legatura, non esca dal campo stesso, ciò che potrebbe facilmente determinarne la perdita. A questo punto si procede alla legatura: il calibro del filo è sempre talmente sottile da non consentire di usare le dita, così che la legatura deve essere eseguita con la pinzetta e il portaaghi. Il filo verrà posto in trazione sul nodo solo quel tanto che basta a portare in contatto il margine delle pareti dei monconi, senza strozzarne i tessuti, sempre quindi cercando di ridurre al minimo il trauma della legatura. Il nodo non dovrà mai essere così stretto da non consentire la visione di una piccola porzione di filo prima che esso si affondi nella parete. Il secondo punto di sutura verrà apposto, con le stesse modalità del primo, esattamente a 1200 dal primo sulla circonferenza dei monconi, il che consentirà di allontanare tramite una leggera trazione esercitata sui fili dei due primi punti, la parete posteriore del vaso dalla porzione anteriore della parete che si sta suturando, facilitando così le manovre chirurgiche della sutura. Dopo aver apposto con le stesse modalità il secondo punto, mentre l'assistente tiene in leggera trazione i due fili, si completa la sutura della parete anteriore, per la quale sono necessari, in genere, altri 2-4 punti nel caso di vasi da 1 mm, o anche di più se si tratta di vene. Terminata la sutura del lato anteriore si rovescerà l'angiostato in modo da esporre la porzione posteriore delle pareti e in questa manovra saranno di aiuto i fili dei primi due punti che ancora verranno posti in leggera trazione. Un primo punto verrà apposto nel centro della parete posteriore, la quale quindi verrà a sua volta divisa in due archi di circonferenza di 1200 ciascuno. Fatto ciò, la sutura viene completata. In genere, per arterie attorno al millimetro di diametro si rendono necessari non più di una decina di punti. Nelle vene, dato che la sottigliezza della parete rende l'approssimazione meno facile, a volte sono richiesti alcuni punti in più. L'anastomosi venosa è più difficoltosa e richiede una maggiore accuratezza, anche perché, forse a causa del più lento flusso del sangue, le trombosi postoperatorie sono meno rare.
Terminata così l'anastomosi, prima di rilasciare le branche dell'angiostato e dopo aver abbondantemente lavato il campo con una soluzione fisiologica, per asportare l'eparina precedentemente usata, si esamina tutta la circonferenza della sutura a maggiore ingrandimento di quello usato per eseguire l'anastomosi stessa: questa ispezione permette in genere di individuare piccole estroflessioni dei tessuti verso l'esterno e quindi la formazione di boccucce che potrebbero determinare una emorragia, una volta rilasciato il clamp. Se l'approssimazione delle pareti appare invece regolare e uniforme, si procede alla rimozione della branca dell'angiostato che chiude il moncone situato distalmente rispetto al normale senso del flusso ematico in quel vaso, cioè nelle arterie si rilascerà prima la branca distale e nelle vene quella prossimale: in tal modo il sangue invaderà la sede dell'anastomosi per via reflua, consentendo di individuare eventuali perdite senza causare, in genere, emorragie di entità tale da inondare il campo, in quanto la pressione del sangue refluo è minima. Solo quando ci si sarà accertati di una buona tenuta dell'anastomosi si rilascerà il secondo moncone. Di norma si ha a questo punto, specie nelle arterie, un certo sanguinamento tra i singoli punti di sutura che, se moderato, non deve preoccupare: esso anzi indica che i punti non sono stretti tanto da strozzare la parete, e può essere arrestato con una moderata compressione eseguita per alcuni minuti con garza bagnata di soluzione fisiologica. Dopo che l'emorragia tra i punti di sutura si è arrestata, si può osservare il funzionamento del vaso e, nel caso di un'arteria, la sua pulsazione. Questa tuttavia, poiché può essere trasmessa per trazione pulsante sulle pareti del vaso anche in caso di occlusione trombotica del lume, non rappresenta un segno certo della pervietà dell'anastomosi, che è invece dimostrabile dopo alcuni minuti dalla sua esecuzione, con la cosiddetta ‛prova della mungitura': i due monconi del vaso vengono delicatamente afferrati sui due lati, e a una certa distanza dalla linea dell'anastomosi, con le pinzette tenute moderatamente strette - così da occludere il vaso senza schiacciarlo - e fatte scorrere allontanandole dalla linea di sutura in modo da svuotare del contenuto ematico il tratto di vaso tra esse compreso. Rilasciando una pinzetta, si osserva il passaggio del sangue attraverso l'anastomosi stessa; la prova viene quindi ripetuta, rilasciando l'altra pinzetta. La prova migliore sarà comunque il reperto di una buona circolazione nel tessuto dipendente dai vasi anastomizzati, senza pallore o cianosi, e con un normale sanguinamento in periferia. In alcuni casi, soprattutto per le anastomosi arteriose, prima di iniziare l'anastomosi stessa, si può introdurre uno dei due monconi arteriosi entro un cilindretto di vena prelevato da una vena delle vicinanze che, alla fine della sutura, viene stirato fino a ricoprire la linea dell'anastomosi come una fascia: ciò consente di rendere minimo il sanguinamento e quindi di applicare un numero di punti inferiore a quello usuale.
In assenza di ritorno della circolazione a valle dell'anastomosi, evidenziato dal mancato sanguinamento dei tessuti, come anche in caso di cianosi congestizia del tessuto stesso, vi è ragione di ritenere che le anastomosi, arteriosa nel primo caso e venosa nel secondo, non funzionino. In tale evenienza bisogna ante omnia ispezionare accuratamente i vasi anastomizzati onde poterne escludere torsioni o inginocchiamenti tali da impedire il libero deflusso ematico. Ci si accerterà anche che i vasi, e segnatamente l'arteria, non siano in spasmo, cosa che accade non di rado e soprattutto a livello del punto di applicazione delle branche dell'angiostato. Tali spasmi recedono in genere sollecitamente trattando con impacchi di marcaina o lidocaina o con soluzione fisiologica tiepida il segmento di vaso interessato. Se la circolazione venosa e arteriosa non si ristabilisce, bisogna sospettare, specie nel caso di pregressi traumi, la presenza di lesioni intimali anche lontane dalla linea dell'anastomosi, per scollamento o per contusione: in queste condizioni la trombosi che ne consegue è difficilmente rimediabile. Invece, nell'eventualità, evidenziabile con la manovra della mungitura, che la trombosi sia avvenuta a livello dell'anastomosi, come accade in casi di esecuzione non perfetta, non ci si dovrà limitare all'apertura della sutura e alla rimozione del coagulo, seguite da una nuova anastomosi, perché le probabilità di una nuova trombosi sono altissime: sarà invece necessaria la resezione di un tratto di vaso sui due versanti e l'esecuzione di una nuova anastomosi. Se la nuova resezione allontana i lumi beanti dei monconi e quindi l'anastomosi avviene sotto tensione, è opportuno inserire tra i monconi stessi un innesto venoso.
La tecnica descritta, essenzialmente identica per le arterie e per le vene, è valida in tutti i casi di corrispondenza di calibro dei vasi da suturare, se esiste nel campo operatorio spazio sufficiente per poter ruotare l'angiostato approssimatore così da esporre senza difficoltà la parete posteriore. Nel lavoro clinico non sempre si verificano queste condizioni favorevoli e talora si deve procedere ad anastomosi in regioni profonde che non consentono queste manovre: in tali casi si dovrà ricorrere a una sutura della parete che, iniziando dalla faccia posteriore, proceda parallelamente sui due lati del primo punto sino alla faccia anteriore, in modo da evitare la rotazione dell'angiostato. Diversamente, in alcuni casi, è necessario ricorrere all'anastomosi terminolaterale che, per l'impossibilità di ruotare l'angiostato, deve sempre essere iniziata dalla parete posteriore: aperta una fessura orientata secondo l'asse del vaso ricevente e di grandezza appena superiore al diametro del vaso che deve esservi suturato, l'apposizione dei punti avrà inizio dal centro del suo labbro e si estenderà sui due lati sino a completare la parete posteriore; successivamente si eseguirà la sutura della parete anteriore procedendo dalle estremità verso il centro con punti staccati alternativamente sui due lati.
c) Innesti micro vascolari.
L'innesto microvascolare è indispensabile in tutti i casi, in parte già menzionati, in cui si sia resa necessaria una resezione dei vasi tanto estesa da non consentire più il diretto riavvicinamento dei monconi vasali senza sottoporre l'anastomosi a tensione, come accade quasi sempre nel reimpianto delle dita amputate; oppure in tutti i casi in cui sussista una notevole differenza di calibro tra i due vasi da anastomizzare, come è frequente nei trasferimenti di tessuti da una regione all'altra.
L'innesto microvascolare è più frequentemente venoso, perché è più facile reperire vene adatte, come quelle superficiali del sottocutaneo che in genere possono essere sacrificate senza conseguenze per la circolazione locale. L'esecuzione di un microinnesto arterioso comporta in genere il sacrificio di un'arteriola con circolazione terminale e quindi non sacrificabile senza recare un danno vascolare alla regione che circolatoriamente ne dipende. Inoltre le vene, avendo pareti più sottili e più dilatabili, meglio si adattano alle discrepanze di calibro che in genere si vogliono correggere. Le sedi dalle quali più frequentemente si prelevano vene da innestare sono il dorso del piede, la faccia volare dell'avambraccio, il dorso della mano; spesso, comunque, tali vene si possono reperire già nel campo operatorio ove si sta eseguendo l'anastomosi.
Nei casi in cui si debba riparare un'amputazione multipla di dita, microinnesti venosi o arteriosi si possono ottenere dal dito o dalle dita che per qualunque ragione non sia possibile reimpiantare, a beneficio di quelle invece reimpiantabili. In caso di innesti venosi, specialmente se prelevati dall'arto inferiore, si dovrà tener presente la possibile presenza di valvole, per cui sarà necessario marcare l'estremità distale del microinnesto e assicurarsi che detta estremità vada anastomizzata in posizione tale da non costituire, con le sue eventuali valvole, ostacolo al flusso sanguigno nel segmento innestato. La lunghezza dei microinnesti venosi è variabile: raramente inferiore al centimetro, più sovente supera i 2-3 cm. In proposito gioverà considerare che S. Fujikawa ha sperimentalmente dimostrato che negli innesti microvascolari di vena l'occlusione trombotica è direttamente proporzionale alla lunghezza dell'innesto stesso, almeno sino a una lunghezza di 4 cm; in questi innesti, purché correttamente eseguiti, la percentuale di trombosi si discosta poco da quella incidente nelle normali anastomosi senza innesto.
Il segmento microvascolare prelevato deve essere manipolato con estrema delicatezza, lavato abbondantemente con soluzione fisiologica eparinata al 10% e disposto tra i due monconi vasali tra i quali deve essere inserito. Talvolta la sua lunghezza è tale da non consentire la posizione dei normali angiostati approssimatori sui due monconi, in quanto la barra su cui le due branche sono applicate non supera in genere i 2,5-3 cm: in questi casi si possono montare semplici angiostati singoli a molla su una barretta metallica (la chiave delle branche funziona spesso egregiamente alla bisogna) e ottenere così un distanziamento maggiore. L'apposizione dei punti si eseguirà secondo le modalità già descritte per la normale anastomosi, procedendo però alternativamente e parallelamente sulle due linee anastomotiche in modo da non creare torsioni dell'innesto e da conferire una graduale stabilità allo stesso. Quindi, dopo avere apposto un punto in posizione simmetrica sulle due estremità del microinnesto, se ne applicherà un secondo a 120°, sempre simmetricamente sulle due estremità, e si procederà quindi alternativamente come descritto per le semplici anastomosi.
d) Terapie anticoagulanti postoperatorie.
Come è noto, la lesione di un vaso sanguigno scatena una reazione che inizia con l'aggregazione delle piastrine e porta alla formazione di un coagulo nel punto stesso della lesione. Ne deriva l'imperativo per la microchirurgia vascolare di limitare quanto più possibile ogni manovra traumatica. Cionondimeno sia la sezione del vaso, sia le varie indispensabili manovre chirurgiche, e segnatamente la penetrazione dei fili di sutura, producono una lesione spesso sufficiente alla formazione di un trombo. Ove ci si limiti però a questi traumi chirurgici minimali e se si opera su vasi precedentemente sani e che non abbiano subito traumi, in genere non è necessario porre in atto terapie mediche postoperatorie anticoagulanti per prevenire la formazione del trombo.
In pratica, però, queste condizioni si verificano molto raramente: infatti, in tutti i casi di reimpianti, il trauma amputante ha in genere procurato un danno vascolare di entità varia, ma mai trascurabile; inoltre, le pareti dei vasi situati in regioni anatomiche in vicinanza di focolai infiammatori cronici, come ad esempio i focolai osteomielitici degli arti inferiori, in cui spesso si utilizzano i lembi liberi osteocutanei composti, possono presentare fibrosi e ispessimento intimale. In questi e in altri casi, soprattutto in tutti i reimpianti di segmenti di arti o di altri organi amputati, nei quali certamente il trauma dei vasi non è mancato, è opportuno instaurare, a giudizio del chirurgo, una terapia anticoagulante per via generale. Questa si basa sulla somministrazione di: aspirina, che è un ottimo antiaggregante piastrinico e previene quindi la prima fase della formazione del trombo parietale; eparina, come antitrombotico; dipiridamolo, in quanto capace di inibire la liberazione delle piastrine; dextrano a basso peso molecolare, in quanto capace di inibire l'impilamento delle piastrine stesse. Si potranno poi associare altri farmaci a discrezione del chirurgo. La conoscenza dei meccanismi della coagulazione del sangue e dei fenomeni istopatologici che intervengono nell'occlusione dei piccoli vasi permetterà di eseguire una terapia mirata per intervenire sui punti chiave di questi fenomeni.
4. Applicazioni della microchirurgia vascolare.
Come abbiamo già avuto occasione di accennare, le tecniche sin qui descritte sono applicabili a diverse branche della chirurgia, sia generale che specialistica, e sarebbe pertanto impossibile descrivere dettagliatamente tutte le operazioni nelle quali la microchirurgia vascolare è di ausilio. In questa sede possiamo solo accennare brevemente, e in maniera certamente incompleta, a quelli che sono gli interventi di routine in microchirurgia e anche a quelli che, seppure proposti recentemente, si stanno diffondendo rapidamente.
a) Reimpianti.
Un segmento di arto, sia esso uno o più dita, la mano o il braccio così come il piede o la gamba, può essere reimpiantato e la sua funzione recuperata in parte o quasi completamente se, oltre a ristabilire le connessioni delle ossa e delle parti molli, se ne ristabilisce in breve tempo la circolazione sanguigna e si creano le condizioni per un ripristino delle funzioni nervose, motrici e sensitive. Anche altri tessuti e organi, come lo scalpo, i lembi di cute e il pene, sono stati reimpiantati con successo a seguito di avulsioni o amputazioni traumatiche. Per tutti questi reimpianti il punto chiave dell'intervento ricostruttivo è la restaurazione della circolazione arteriosa e venosa. Le indicazioni e controindicazioni al reimpianto possono derivare da condizioni di carattere generale o locale; tra le più importanti condizioni generali si ricordano le seguenti.
1. Età. - Anche se un limite preciso è difficile da stabilire, è naturale che l'età avanzata, per i riflessi che può avere sullo stato dei vasi periferici e segnatamente delle arterie, può in alcuni individui sconsigliare il reimpianto. Alcuni autori consigliano di non procedere al reimpianto oltre i 60 anni. Tale valutazione probabilmente tiene anche conto della minore capacità riabilitativa dell'anziano per il minore adattamento a lui consentito. Per contro, l'opportunità di un reimpianto deve essere valutata molto attentamente anche in caso di soggetti di età molto giovane, dato che non si può contare sulla loro collaborazione nella fase riabilitativa.
2. Stato di salute. - Tutte le malattie croniche che abbiano negative influenze sullo stato dei vasi periferici, quali diabete di media o intensa gravità, gravi disfunzioni epatiche e renali, malattie del sangue e difetti della coagulazione, sono da prendere in seria considerazione per gli effetti negativi che possono avere sul decorso e sullo stesso successo di un reimpianto.
3. Tempo trascorso. - La morte dei tessuti, a meno che non siano distrutti gli equilibri idrosalini cellulari interstiziali, come ad esempio nelle ustioni, non è istantanea. È altresì noto che la sopravvivenza del tessuto è legata alle sue riserve metaboliche, segnatamente a quelle di ossigeno. Il tempo di sopravvivenza di un tessuto in condizioni di ischemia è quindi inversamente proporzionale alla vivacità del suo metabolismo, per cui muscoli e cartilagini, per esempio, sopravvivono a temperatura ambiente non oltre le 6 ore, mentre tendini e adipe, che sono tessuti a metabolismo più lento, sopravvivono più a lungo. La regola che sconsiglia il reimpianto se non si può ristabilire il flusso arterioso entro 6 ore dal trauma amputante andrà comunque interpretata con buon senso, tenendo sempre presente il quadro generale e l'importanza dell'organo da reimpiantare. Così il termine è categorico per grossi segmenti tipo braccia o arti inferiori, ove il tessuto muscolare è ampiamente rappresentato; nella formulazione del giudizio deve essere tenuta ben presente la pericolosità delle miotossine che un muscolo necrotico mette in circolo e che possono dare quadri frequentemente mortali di blocco renale (crush-syndrome degli anglosassoni). Casi infausti non sono mancati neppure in Italia a seguito di reimpianti eseguiti oltre i limiti di tempo di sicurezza. Il reimpianto di un piccolo organo, quale un dito o il pene, può invece essere tentato con minor rischio, in quanto la quantità di tossine riassorbibili rilasciate in caso di esito sfavorevole con necrosi del reimpianto sarebbe modesta, e quindi anche i rischi generali conseguenti accettabili, in rapporto all'enorme importanza di poter salvare, ad esempio, un pollice o il pene.
Il tempo di sopravvivenza in condizioni di ischemia può essere prolungato anche notevolmente, purché il segmento amputato sia conservato in ambiente adatto e convenientemente refrigerato. Un facile modo di conservazione che consente di raddoppiare o triplicare il tempo di sopravvivenza in condizioni di ischemia consiste nell'immergere il segmento da reimpiantare in un sacchetto di plastica contenente soluzione fisiologica, eventualmente con aggiunta di antibiotici, ma non di disinfettanti; il sacchetto viene quindi ricoperto di ghiaccio, il che rende possibile refrigerare il tessuto, rallentandone il metabolismo, pur senza portare la temperatura tanto in basso da rischiare il congelamento. Infatti attorno a 0 °C la formazione di cristalli nel tessuto e i conseguenti gravi squilibri idrosalini interstiziali determinano rottura e morte cellulare e quindi necrosi del tessuto stesso. Questa semplice refrigerazione é utilissima per prolungare il tempo di sopravvivenza, e oggi reimpianti di tessuti così conservati sono spesso eseguiti anche dopo 15-16 ore dall'amputazione. La diffusione di queste semplici nozioni nei pronto soccorso periferici sarebbe assai utile ai fini di poter avviare ai pochi centri specialistici tessuti vivi, in condizioni ottimali per poter essere reimpiantati con ragionevole sicurezza.
Nel valutare l'opportunità di un reimpianto, non minore importanza hanno le cause locali che hanno determinato la lesione. Segmenti amputati nettamente con strumenti affilati sono in genere caratterizzati da danno vascolare minimo e quindi sono quasi sempre candidati al reimpianto; di norma, però, questi casi favorevoli sono rari e più frequente è il riscontro di traumi complessi. In caso di avulsioni abbiamo già ricordato l'importanza di poter disporre di vasi abbastanza integri e senza slaminamento delle tonache, e i limiti che questo tipo di trauma impone. Anche qui il buon senso guiderà il chirurgo nella valutazione, perché se è talora accettabile il rischio della necrosi di un dito o di un lembo di scalpo, troppo alti sono i rischi del mancato attecchimento di un grosso segmento di arto in amputazioni di braccio o di coscia. Nei traumi contusivi con mortificazione dei tessuti raramente sussistono ragionevoli possibilità di successo e quindi l'intervento è spesso controindicato. Un altro fattore che aggrava notevolmente la prognosi del reimpianto è la presenza di fratture, specie multiple, nei segmenti distali (mani e piedi), a causa dell'edema che esse determinano.
Qualche problema valutativo particolare si pone nel reimpianto delle dita. Dal punto di vista della sopravvivenza si è già detto che le dita lasciano al chirurgo un certo margine discrezionale di scelta, in quanto più facile è la sopravvivenza per la scarsità del tessuto muscolare e minori sono i rischi generali di un eventuale fallimento. Cionondimeno, altri fattori, quale il fattore tempo, intervengono e talora sconsigliano il reimpianto; infatti, va tenuto presente che tra periodo postoperatorio, periodo richiesto per ottenere una buona reinnervazione, eventuali reinterventi correttivi per i postumi cicatriziali e periodo necessario alla terapia riabilitativa, sono non di rado necessari 6 mesi prima che il paziente riesca a recuperare la libera disponibilità della sua mano e la piena capacità lavorativa. Questo può essere un prezzo accettabile da pagare se il dito amputato è importante, come un indice o un pollice, specie della mano dominante; invece, un'accurata valutazione di tutti i fattori andrà fatta nel caso, ad esempio, dell'amputazione di mignolo, di anulare o di medio, considerando che una semplice reamputazione pone di solito il paziente in condizione di riprendere i lavori manuali in 15 giorni e l'invalidità permanente reale è, salvo particolari lavori, del tutto trascurabile. È chiaro che occupazioni particolari che richiedono la perfetta funzione di tutte le dita possono autorizzare ad accettare i rischi e gli oneri di un reimpianto. In caso di amputazioni multiple sarà sempre tenuto presente l'ordine di importanza delle dita: pollice, indice, medio, anulare e mignolo. Poiché raramente sussiste il tempo sufficiente per reimpiantarle tutte, è ovvio che si inizierà da quelle più importanti. Nel caso però che pollice o indice siano anche contusi o fratturati, e quindi non utilizzabili, si potranno invece reimpiantare le residue dita. Va comunque osservato il principio generale che il rempianto di segmenti di arto, di dita o di estremità è utile solo se permette di recuperare una funzione; se pertanto tale recupero appare improbabile anche in caso di attecchimento del reimpianto, per la presenza di concomitanti lesioni nervose o miotendinee, l'intervento non deve essere effettuato.
Ovviamente non è questa la sede per descrivere nei dettagli la tecnica operatoria dei reimpianti, che d'altronde varia a seconda dell'organo interessato e, nel caso degli arti, del livello al quale è avvenuta l'amputazione. Per quanto riguarda comunque i reimpianti più frequenti, che sono quelli di segmenti dell'arto superiore, il chirurgo dovrà affrontare nell'ordine i seguenti stadi riparativi: 1) fissazione ossea con osteosintesi metallica: in genere si applica una placca a vite, ma in alcuni casi si possono usare i fissatori esterni e, limitatamente alle dita, anche gli aghi di Kirschener; 2) anastomosi microvascolari: in genere è preferibile eseguire prima l'anastomosi dell'arteria, sia per accorciare il tempo di ischemia, sia perché così riprende il sanguinamento venoso, ciò che può facilitare il reperimento delle sottili vene soprattutto a livello delle dita; 3) riparazione miotendinea; 4) riparazione dei nervi con tecnica microchirurgica; 5) sutura delle parti molli e della cute. Per tutti i dettagli, peraltro importantissimi, della tecnica si rimanda il lettore ai trattati specialistici.
b) Lembi liberi.
Le plastiche cutanee esistono da tempo immemorabile ed esempi di innesti di cute si trovano in letteratura a datare da vari secoli. Basti ricordare le rinoplastiche ricostruttive di Gaspare Tagliacozzi nella Bologna del 1500. Condizione indispensabile all'attecchimento di un trapianto di cute, come per ogni altro tessuto, è la possibilità di un congruo apporto nutritizio che, per gli innesti molto sottili, può avvenire inizialmente per diffusione sieroplasmatica, in attesa che si riformino vasi sanguigni a ristabilire una circolazione nel lembo trapiantato. Per innesti di maggiore spessore si dovrà procedere per gradi, lasciando il lembo sempre connesso al corpo con un peduncolo che ne assicuri la nutrizione e che sarà sezionato solo quando si avranno garanzie di una sufficiente formazione di nuovi vasi, attraverso la cicatrice, in grado di nutrire il lembo. Quindi il trasferimento dei lembi a distanza, sino a non molti anni or sono, avveniva solo a stadi subentranti e con un lunghissimo dispendio di tempo, dato che ogni stadio richiede almeno tre settimane prima che si sia formata una nuova circolazione.
La microchirurgia vascolare ha messo in grado il chirurgo di connettere vasi sanguigni del lembo, di calibro di 1 mm e anche meno, con quelli della regione ricevente, ristabilendo così immediatamente una circolazione; ciò consente non solo di trasferire in un sol tempo lembi di cute di misura mai raggiunta prima, ma anche di includere nel lembo altri tessuti, come osso, muscolo, ecc., purché dipendenti da uno stesso o dagli stessi vasi nutritizi che verranno anastomizzati. Questa tecnica ha offerto la possibilità di applicazioni precedentemente impensabili e consente riparazioni immediate anche di lesioni estremamente complesse e gravi. Valga da esempio il caso di una frattura esposta multipla con ampia perdita di sostanza cutanea e con grave mortificazione delle parti molli. Con i sistemi tradizionali la ricostruzione del mantello cutaneo, indispensabile alla guarigione della frattura stessa, avrebbe richiesto un tempo tale che l'osso, restando scoperto, sarebbe facilmente andato incontro a osteomielite e quindi a necrosi con conseguente perdita dell'arto. Oggi siamo in grado di trasferire in un unico tempo un lembo libero osteocutaneo, ad esempio della regione inguinoaddominale, includente osso della cresta iliaca, e riparare così contemporaneamente la perdita delle parti molli e l'eventuale perdita ossea dovuta alla rimozione di frammenti ossei in una frattura comminuta. Non solo, ma in genere questi lembi liberi vengono anastomizzati a vasi di una certa importanza, come ad esempio, nella gamba, l'arteria tibiale anteriore e la vena safena; ne consegue un'iperemia del lembo stesso rispetto alle condizioni originali, e il migliorato apporto nutritizio della regione non solo risulta utile nella lotta alle infezioni che il trauma può avere apportato, ma accorcia il periodo di guarigione della lesione nel suo complesso. In caso di perdite di tessuto osseo, l'ortopedico già da gran tempo è in grado di eseguire trapianti di osso seguendo sistemi tradizionali; in questo caso, però, l'osso, essendo privo di una propria circolazione, è destinato a un lento riassorbimento. Questo tipo di intervento è comunque utile perché serve da trama all'invasione riparatrice, dai monconi, di osteoblasti che rigenerano l'osso, ma l'evoluzione di tale processo richiede molti mesi anche per perdite modeste. L'osso che viene trapiantato con tecniche microchirurgiche, associato o meno alla cute, è invece un osso vitale e, se ben fissato ai monconi, consente una guarigione in un tempo assai vicino a quello che sarebbe necessario alla guarigione di due fratture. Queste metodiche sono designate col nome di ‛lembi liberi microvascolari' per indicare che il lembo ha perso in un solo stadio ogni connessione, anche vascolo-nervosa, con la sua sede di origine e che è stato collegato alla circolazione della sede ricevente con tecnica microchirurgica. Il lembo libero, costituito non solo di pelle totale (epidermide, derma, grasso ipodermico, fascia superficialis e adipe), ma anche di altri tessuti (osso, muscolo, periostio, tendini, ecc.), viene definito come ‛composto' e può essere osteocutaneo, tenocutaneo, miocutaneo, ecc. Ogni lembo libero deve possedere una vascolarizzazione assiale, arteriosa e venosa, con vasi che non devono essere molto al disotto di 1 mm di diametro. In quelle riparazioni in cui è indispensabile che la cute trasferita sia anche sensibile, i lembi debbono includere un nervo da collegare a quello presumibilmente interrotto della regione ricevente.
I lembi cutanei liberi più comuni, tra i numerosi possibili, sono: il lembo inguinoaddominale (groin flap), basato sui vasi circonfiessi iliaci superficiali e profondi; il lembo dorsale del piede, basato sull'arteria pedidia e sulla vena safena; il lembo deltopettorale, basato sui rami perforanti della seconda arteria intercostale con le sue vene; il lembo frontale, basato sull'arteria temporale superficiale e su vene varie; il lembo retroauricolare di Fujino, basato sui vasi retroauricolari; il lembo della prima commissura interdigitale del piede, basato sui rami terminali digitali dell'arteria e delle vene pedidie. I lembi liberi composti sono ancora più numerosi e praticamente ogni lembo miocutaneo peduncolato può essere usato anche come lembo libero se deve essere trasferito a distanza. Tra essi i più frequenti sono forse il lembo miocutaneo del latissimo del dorso, il lembo miocutaneo del gastrocnemio mediale e laterale, che vengono spesso usati per la riparazione di perdite traumatiche, il lembo miocutaneo del grande gluteo che è stato recentemente proposto per la ricostruzione della mammella dopo mastectomia.
È ovvio che la tecnica operatoria varierà a seconda della regione di prelievo del lembo, di quella ricevente, del tipo di difetto che si deve riparare e dello stato dei vasi della regione ricevente. In linea di massima, comunque, si mizierà sempre dalla ricerca dei vasi del lembo da trasferire, che è spesso indaginosa e molto delicata. Poiché nel caso di certi lembi i vasi possono variare per numero e caratteristiche anatomiche, se ne dovranno valutare calibro e caratteristiche in funzione della possibilità di utilizzarli per l'anastomosi. Ove il giudizio sia positivo, una équipe scolpirà il lembo mentre una seconda équipe preparerà il difetto da ricoprire e ne reperirà i vasi riceventi. In casi in cui possano sussistere dubbi sulla loro presenza e idoneità all'anastomosi, per qualsivoglia ragione, sarà opportuno procedere al loro reperimento e ispezione prima di scolpire il lembo. Poi, mentre un'équipe esegue l'anastomosi, l'altra provvede alla chiusura della regione donatrice del lembo stesso.
c) Altri trapianti liberi micro vascolari.
Anche altri tessuti possono venir trasferiti in un unico tempo grazie alle anastomosi microvascolari con vasi della regione ricevente. I tessuti che, sino ad ora, sono stati trapiantati con maggior successo sono i seguenti.
1. L'omento, che, disponendo di vasi assai facili da anastomizzare per il loro calibro di 2 mm e oltre, è stato usato per riparazioni di emiatrofie facciali di Romberg con anastomosi ai vasi facciali. Nella ricostruzione delle parti molli attorno al plesso brachiale, in casi di lesioni del medesimo da irradiazioni della regione sopraclaveare, per lo più per metastasi da carcinoma mammario, l'omento, i cui vasi gastroepiploici vengono anastomizzati a vasi della regione che siano però indenni da irradiazione (ad es. l'arteria tiroidea superiore e una vena giugulare), non solo offre la protezione di un tessuto soffice al plesso brachiale, ma migliora notevolmente la nutrizione della regione rispetto alla precedente fibrosi da raggi. L'omento è stato anche usato per ricoprire difetti cutanei vari in associazione a un innesto dermoepidermico tradizionale.
2. Il periostio è un tessuto che, soprattutto nei giovani, ha una notevole capacità osteogenetica e può quindi venire convenientemente usato per la riparazione di pseudoartrosi congenite. In genere si usa il periostio costale con i vasi mammari interni da anastomizzare a vasi della regione ove è presente la pseudoartrosi.
3. L'osso può ovviamente essere utilizzato anche senza cute per la riparazione di difetti delle ossa lunghe senza interessamento delle parti molli. Il perone con la sua arteria nutritizia può essere usato per riparazioni di difetti di altre ossa lunghe. Costole, in genere la sesta o la settima, come previsto da McKee, sono state usate per la ricostruzione di emi mandibola: in genere il peduncolo dei vasi è quello della mammaria interna e viene anastomizzato ai vasi facciali. Le piccole articolazioni del piede con monconi di metatarso e di falange sono state trapiantate per la ricostruzione di articolazioni della mano, utilizzando i vasi digitali del piede da anastomizzare ai rami radiali o ulnari.
4. I muscoli sono stati impiegati nei trapianti per lo più come lembi liberi composti miocutanei con intenti di protezione e di ricostruzione morfologica, e talvolta per sfruttare la loro capacità contrattile. Tra i trapianti di muscolo con intenti di ricostruzione dinamica ricordiamo quello dei 4 capi del muscolo estensore breve delle dita del piede pro faccia, in casi di paralisi inveterata del nervo facciale: tramite un innesto, il nervo di tale muscolo viene collegato, in genere in due tempi, a rami del nervo facciale del lato sano controlaterale, mentre i suoi vasi - rami dell'arteria dorsale del piede e delle vene concomitanti - si anastomizzano ai vasi facciali. Anche il muscolo gracile della coscia è stato impiegato a questo scopo, ma il suo uso non si è diffuso, perché i risultati erano esteticamente insoddisfacenti.
Anche alcuni organi sono oggetto di trapianto libero con tecnica microchirurgica. È questo il caso del testicolo ectopico, il quale è talora ritenuto in addome in una qualunque posizione lungo il decorso della normale discesa che esso compie nell'embriogenesi sino ad arrivare nello scroto. Talvolta la mobilizzazione chirurgica e il trasferimento nello scroto sono impediti dalla brevità dell'arteria; in tali casi, tuttavia, poiché il deferente e a volte anche le vene sono sufficientemente lunghi da consentire il trasferimento, si può sezionare l'arteria e trasferire il testicolo nello scroto anastomizzando la sua arteria principale, cioè l'arteria spermatica interna, all'arteria epigastrica superficiale a livello dell'uscita del canale inguinale. In genere, svolgendo il percorso convoluto delle vene, è possibile trasferire il testicolo senza ricorrere ad anastomosi vascolari.
Per la ricostruzione dell'esofago cervicale sono state usate anse intestinali, anastomizzando i vasi all'arteria tiroidea superiore e alle vene giugulari. Sulianegara e altri consigliano di utilizzare in questo caso il colon trasverso, mentre la maggior parte dei chirurghi, sulla scorta di quanto sostenuto da May e altri (1981) e da Seidemberg e collaboratori, preferiscono l'uso di anse digiunali. La tecnica è stata usata anche nell'uomo per la ricostruzione esofagea in casi di esofagectomie per neoplasie.
d) Applicazioni di chirurgia sperimentale.
La microchirurgia vascolare consente poi numerosi interventi di chirurgia sperimentale, quali i trapianti renali nel ratto e interventi di derivazione del coledoco, sempre nel ratto o nel coniglio. Anche la ricostruzione di tube di Falloppio con metodi microchirurgici è stata studiata da Cohen e altri. Clinicamente, la pervietà delle tube viene ricostruita asportando il tratto stenotico e rianastomizzando i due monconi. La percentuale di gravidanze ottenute in seguito a interventi di ricostruzione di tube precedentemente legate è altissima, ma è scarsa in caso di annessite cronica, ove alla stenosi si accompagna una distruzione più o meno radicale dell'epitelio ciliato.
Il pene amputato è stato sperimentalmente reimpiantato da Norton e collaboratori anastomizzando un'arteria e una vena dorsale del pene. I risultati miglioravano sensibilmente se venivano riparate due arterie e due vene dorsali, e inoltre una vena cutanea e possibilmente anche un corpo cavernoso.
5. Microchirurgia dei nervi periferici.
a) Cenni anatomici.
È noto che i nervi sono costituiti da fibre nervose o assoni che nascono da cellule nervose dei centri o della periferia. Ogni nervo ha una guaina connettivale esterna, detta epinevrio, la quale invia setti verso l'interno a interporsi tra i fascicoli o i gruppi di fascicoli nervosi. È nell'epinevrio che decorrono i vasi nutritizi del nervo. Un'altra guaina, il perinevrio, avvolge ogni fascicolo e con la sua superficie esterna è a contatto con l'epinevrio o i suoi setti. Infine le fibre nervose all'interno del fascicolo sono divise in gruppi, ognuno dei quali è circondato dall'endonevrio. Le singole fibre nervose non decorrono costantemente nello stesso fascicolo per tutta la lunghezza del nervo, ma possono passare a un altro fascicolo dello stesso nervo, così che frequenti sono le anastomosi fra fascicoli e le variazioni di calibro di uno stesso fascicolo a diversi livelli. La microchirurgia dei nervi periferici si attua quasi essenzialmente sui fascicoli secondari.
b) Strumentario.
Gli strumenti utilizzati per la microchirurgia dei nervi periferici sono sostanzialmente gli stessi già descritti per la microchirurgia vascolare. Ovviamente, non sono necessari gli angiostati, ma egualmente sono indispensabili pinzette da orologiaio dal numero 1 al 5, forbici, portaaghi per microchirurgia, fili per lo più di nylon 10/0, in tutto identici a quelli già descritti. Il microscopio, essenziale nella microchirurgia dei nervi, in genere deve poter offrire ingrandimenti alquanto maggiori di quelli usati in microchirurgia vascolare. L'elettrocoagulatore bipolare è indispensabile, in quanto la legatura dei vasa nervorum come la loro elettrodiatermocoagulazione sarebbero manovre oltremodo pericolose per le strutture nervose vicine. L'elettroneurostimolatore consente di reperire i rami nervosi e di individuarne le componenti motrici.
c) Lesione di nervi periferici.
Se un nervo viene sezionato, le sue fibre si interrompono e la parte più lontana dai centri va incontro alla ben nota degenerazione walleriana. Secondo la classificazione suggerita da Seddon e ormai universalmente accettata, si distinguono i seguenti tipi di lesioni nervose. La neurotmesi è la sezione completa del nervo con interruzione della sua continuità: se non si interviene il difetto viene invaso da un tessuto cicatriziale che si interpone tra i monconi delle singole fibre impedendone la rigenerazione. La causa di questa lesione è sempre chirurgica o traumatica. La axonotmesi è l'interruzione delle fibre nervose o assoni e delle loro guaine mieliniche, mentre restano integri i tessuti di sostegno (endonevrio, perinevrio ed epinevrio). Questa è una lesione prodotta da corpi contundenti e da compressione, che spesso consegue a incauta ed eccessiva pressione di strumenti divaricatori in corso di operazioni chirurgiche o a compressione da parte di segmenti ossei dislocati a seguito di fratture. I tessuti perineurali al pari di epinevrio e perinevrio sono integri. Infine la neuroapraxia è quella condizione in cui, a causa di una demielinizzazione delle fibre nervose, che sono integre, è temporaneamente perduta la capacità di trasmissione degli stimoli nervosi. Questa lesione si verifica a seguito di traumi di modesta entità, compressioni, trazioni.
È ben noto che una fibra nervosa che sia stata interrotta tende a rigenerare, ove essa sia posta in continuità con le guaine del moncone distale, o con quelle di un'altra fibra. La rigenerazione avviene lentamente ma sicuramente sino a ottenere la completa reinnervazione dei tessuti cui la fibra interrotta era originariamente diretta. Nell'axonotmesi quindi la lesione non ha bisogno di trattamenti chirurgici, in quanto, non essendovi interruzione delle guaine nervose, l'assone può rigenerare solo lungo le sue guaine. Viceversa nella neurotmesi, quando almeno un fascicolo, e non solo alcune fibre, è interrotto, le possibilità che una fibra possa imboccare nuovamente una guaina lasciata vuota dalla degenerazione walleriana della porzione distale della fibra stessa sono minime, sia perché il nervo sezionato si ritrae creando un difetto, sia perché il tessuto cicatriziale proveniente dal tessuto connettivo di sostegno, segnatamente dall'epinevrio, si va a interporre tra i monconi delle fibre impedendo una regolare riabitazione della guaina vuota da parte di una fibra rigenerante Lo sforzo rigenerativo della fibra si vanifica nella formazione di una masserella di tessuto nervoso, rotondeggiante, chiamata neuroma da amputazione'.
d) Indicazioni della microchirurgia dei nervi periferici.
Scopo della microchirurgia dei nervi è quello di rimettere in connessione i monconi prossimali delle fibre nervose, interrotte o distrutte, con le guaine di fibre degenerate o in corso di degenerazione walleriana, così da consentire alle fibre rigenerantisi di crescere nelle guaine sino alla loro originale destinazione, con una restitutio ad integrum altrimenti impossibile. Tale tipo di intervento è detto neuroraffia.
Nel caso in cui la lesione sia avvenuta a opera di uno strumento ben affilato e quindi i fascicoli siano rimasti separati ma senza mortificazione dei monconi, è possibile e sufficiente la semplice posa in contatto dei due monconi, purché non richieda trazione eccessiva: la trazione, infatti, è sempre uno stimolo vivacissimo alla produzione di cicatrice da parte dell'epinevrio che si interpone tra i monconi, così che ne risulterebbe impedita la rigenerazione e facilitata invece la produzione di un neuroma. In questi casi bisogna anche, con estrema delicatezza, resecare l'epinevrio per un paio di millimetri sui due versanti della linea di sezione del nervo o dei fascicoli onde impedire l'invasione cicatriziale tra i monconi. Prima di procedere alla sutura si asporterà a forbice il fungo di assoplasma o sostanza nervosa che tende a fuoriuscire dal perinevrio, per ottenere poi un più preciso affrontamento dei monconi del fascicolo. La mancata eliminazione di questa protrusione rende l'apposizione dei punti di sutura indaginosa e difficilmente corretta. È possibile ottenere l'approssimazione con pochissimi punti di sutura in nylon 10/0 (un punto dovrebbe essere sufficiente per ogni fascicolo o gruppo di fascicoli), ma l'affrontamento deve essere raggiunto anche senza la trazione del punto o almeno con una trazione del tutto trascurabile. La situazione ideale è quella in cui i monconi restano affrontati e in contatto spontaneamente e i pochi punti servono solo a impedire spostamenti successivi: in questi casi la produzione di cicatrice tra i monconi sarà veramente minima e i suoi effetti risulteranno clinicamente trascurabili. I punti di sutura andranno apposti nella porzione di epinevrio dei setti che si addentrano a separare i fascicoli o gruppi di fascicoli, cercando di limitare il passaggio del filo ai setti epinevriali stessi senza interessare il perinevrio proprio dei fascicoli. La presenza del filo a contatto con le fibre nervose produce infatti un danno che è stato ben dimostrato da studi condotti con il microscopio a scansione. Per ottenere una buona reinnervazione è molto importante riuscire ad affrontare i monconi nervosi tenendo conto della disposizione topografica dei singoli fascicoli o gruppi di fascicoli nella superficie di sezione, in modo che essi si riaffrontino nella posizione originale. L'osservazione microscopica consentirà facilmente, in tutti i casi di semplice e netta sezione, di riconoscere i diversi fascicoli e di riaffrontarli opportunamente. Se trattasi di nervi di un calibro abbastanza grande, può essere utile suddividerli in gruppi di fascicoli da suturare separatamente per impedire spostamenti o rotazioni che farebbero perdere il corretto rapporto tra i monconi fascicolari.
Esistono numerose situazioni in cui il semplice affrontamento dei monconi fascicolari non è possibile nè consigliabile. Ciò avviene quando tra i due monconi esiste un difetto che può essere dovuto a: 1) retrazione elastica dei monconi; 2) distruzione della sostanza nervosa, ad esempio per trauma contusivo esteso o per compressione prolungata; 3) produzione di cicatrice attorno o nel contesto del nervo, che ne determina uno stato di sofferenza e impone una resezione del tratto non normale. In tutti questi casi la restaurazione della funzionalità nervosa si può ottenere solo con la resezione dei neuromi da amputazione o delle parti cicatriziali sino a raggiungere le estremità sane dei monconi e, con l'interposizione di un innesto fascicolare, unire i diversi fascicoli dei due monconi.
In alcune sezioni sarà possibile ovviare alla necessità dell'innesto e ottenere un allungamento del nervo rendendo rettilineo un decorso prima curvilineo o tortuoso. Così, ad esempio, nelle riparazioni del nervo facciale si può ottenere un allungamento raddrizzandone il decorso dei rami preparati con una parotidectomia parziale oppure, in caso di lesioni intrapetrose dello stesso nervo, creando un nuovo canale intraosseo rettilineo. Questi sono però casi eccezionali, mentre di norma sarà necessaria l'interposizione di innesti fascicolari.
Le fonti di prelievo per innesti nervosi sono il nervo surale e il nervo cutaneo mediale dell'avambraccio, in quanto si tratta di nervi sensitivi, la cui ablazione non produce sensibili postumi, ma solo anestesia o ipoestesia limitata che va attenuandosi col passare del tempo. Il nervo surale è il preferibile, sia perché più spesso e più lungo, sia perché la costanza della caratteristica anatomica ne rende facile il prelievo. Contenendo di norma almeno 4 fascicoli, esso ben si presta alla riparazione della maggior parte dei nervi da sottoporre a riparazione. Tuttavia in alcuni interventi, quali la ricostruzione per strappamento del plesso brachiale, anche il prelievo bilaterale dei due nervi surali può non essere sufficiente. Il nervo surale decorre sulla faccia posterolaterale della gamba e da un punto posteriore al malleolo esterno si porta verso l'alto e alquanto medialmente, penetrando in alto nel muscolo gastrocnemio. Attraverso una piccola incisione orizzontale eseguita dietro il malleolo laterale si reperisce il nervo e, sottoponendolo a moderata trazione verso l'esterno con un nastrino di garza, se ne può apprezzare palpatoriamente il decorso sottocutaneo sino alla sua penetrazione sotto la fascia del muscolo gastrocnemio. È quindi facile, con due o tre piccole incisioni, scollarlo ed estrarlo.
Una volta prelevato l'innesto nervoso, sarà necessario preparare il letto per accoglierlo. In ogni caso si dovrà resecare ogni estremità dei monconi che non appaia perfettamente sana: così nel caso di tagli non netti si dovrà resecare una piccola porzione dei monconi sino a cadere nel tratto sano. Nel caso di pregressi traumi contusivi che abbiano prodotto tessuto cicatriziale attorno al nervo e forse nel suo contesto, si dovrà eseguire, sotto osservazione microscopica, una ‛neurolisi fascicolare' con resezione di tutto il tessuto fibroso. Nel caso in cui vi siano alcuni fascicoli che sono solo costretti dal tessuto cicatriziale, sarà sufficiente liberarli; se invece la sostanza nervosa è interrotta, occorre resecare i fascicoli sino a raggiungere il tessuto sano, applicando quindi sul difetto un innesto nervoso. Così nei casi di axonotmesi, in cui, in seguito a compressioni prolungate (esempi tipici le compressioni canalicolari al tunnel carpale per il nervo mediano, al gomito per il nervo ulnare, ecc.), si ha una distruzione di tessuto nobile delle fibre nervose con conservazione delle guaine, occorre accertarsi con l'osservazione microscopica che, all'interno dei fascicoli, non si sia formato tessuto cicatriziale, che impedirebbe la rigenerazione delle fibre. Se questo invece è presente, è necessario operarne la resezione e la sostituzione con innesti, perché la semplice neurolisi fascicolare è insufficiente. Nei casi di neuroapraxia semplice, in genere basta rimuovere la compressione per ottenere la restaurazione funzionale col ritorno della trasmissione degli stimoli. Come avviene in tutte le sindromi canalicolari da compressione, nella sindrome del tunnel carpale la sezione del legamento trasverso del carpo normalizza la funzione nervosa, salvo i casi in cui si sia invece prodotta una axonotmesi, come detto sopra.
e) Applicazioni della microchirurgia dei nervi periferici.
Le applicazioni sono quelle volte alla riparazione delle lesioni dei nervi periferici comunque lesi, siano essi singoli nervi o grossi tronchi nervosi, quale il plesso brachiale, ed essenzialmente non differiscono né nei principi né nella tecnica di esecuzione. Così anche una lesione dei grossi tronchi del plesso brachiale richiederà di ristabilire la continuità delle vie nervose lese con neuroraffie o con innesti.
Nel caso della ricostruzione microchirurgica del plesso brachiale esistono tuttavia dei problemi particolari, quali l'esatta diagnosi del tipo di lesione e la conseguente scelta del trattamento, che rendono la ricostruzione stessa tanto complessa da essere di assoluta pertinenza specialistica.
Un'applicazione del tutto particolare della microchirurgia dei nervi periferici è la riparazione della paralisi del nervo facciale, che è causa di gravissimi danni estetici e funzionali, interessando non solo tutti i muscoli mimici della bocca, del naso, della fronte e della guancia, ma anche gran parte dei muscoli delle palpebre. La paralisi del nervo facciale può avere origine periferica o centrale; le lesioni periferiche possono a loro volta essere acute o inveterate. Nella riparazione delle lesioni periferiche acute la tecnica non differisce da quelle applicate agli altri nervi periferici e quindi sarà volta, con suture o innesti nervosi, a ristabilire sulla faccia la continuità dei rami nervosi, che essendo ormai esili, rendono indispensabile l'uso del microscopio operatorio.
È noto che in tutte le lesioni periferiche di nervi motori i muscoli perdono col tempo la capacità di contrarsi e restano paralitici. In caso di lesioni non recentissime, quindi, prima di procedere alla riparazione si dovrà appurare con adatti esami elettromiografici la persistenza di questa funzione, perchè sarebbe ovviamente inutile ristabilire una innervazione quando non esiste più funzione nell'organo effettore, cioè nel muscolo.
Nel caso di paralisi centrale del nervo facciale, se gli esami elettromiografici dimostrano la conservazione della capacità contrattile muscolare, è possibile operare la riparazione mettendo in connessione i rami terminali del nervo del lato paralitico con rami del nervo del lato sano, che vengono sezionati; questi vengono quindi collegati a un innesto fascicolare che, attraverso il labbro o la fronte, raggiunge il ramo paralitico sull'altro lato della faccia. Sono necessari due o tre di tali innesti. Le fibre del moncone del lato sano, rigenerando attraverso l'innesto, si porteranno sul lato paralitico sino a raggiungere il ramo periferico del nervo paralitico reinnervando così i muscoli paralizzati. Questo processo di rigenerazione richiede molti mesi e può essere seguito sia clinicamente sia con test elettrici, così da poter reintervenire nel caso che la rigenerazione degli assoni si arresti per compressioni, per interposizione di cicatrici o altro. I risultati, particolarmente per la rianimazione della bocca e della guancia, saranno buoni se le indicazioni sono state rispettate e cioè se la capacità contrattile dei muscoli è stata mantenuta. Talora, specie per le palpebre, sono indicate anche altre operazioni non microchirurgiche a integrazione dei risultati nei casi in cui questi siano stati insoddisfacenti: tra esse sono ben note le trasposizioni di muscoli non paralitici quali il temporale e il massetere. Queste procedure non microchirurgiche, o almeno non totalmente microchirurgiche, sono invece indicate come rimedio primitivo nelle paralisi inveterate, nelle quali i muscoli paralitici hanno perduto ogni capacità contrattile. In questi casi però si possono anche utilizzare i già menzionati trapianti liberi microneurovascolari di muscoli, quale il muscolo estensore breve delle dita del piede, di cui si è già parlato a proposito della microchirurgia vascolare.
Queste sono attualmente le applicazioni della microchirurgia ricostruttiva. Non c'è dubbio che l'elenco di interventi ai quali abbiamo sommariamente accennato si andrà allungando nel prossimo futuro: l'inventiva dei chirurghi, infatti, troverà sicuramente utilizzazioni sempre più ampie e brillanti delle tecniche base che abbiamo descritto.
Bibliografia
Acland R., A new needle formicrovascular surgery, in ‟Surgery", 1972, XVII, pp. 130-131.
Acland, R., Prevention of thrombosis in microvascular surgery by the use of magnesium sulphate, in ‟British journal of plastic surgery", 1972, XXV, pp. 292-299.
Acland, R., Thrombus formation in microvascular surgery: an experimental study of the effects of surgical trauma, in ‟Surgery", 1973, LXXIII, pp. 766-771.
Baxter, T. J., O'Brien, B. M., Henderson, P.N., Bennett, R.C., The histopathology of small vessels following microvascular repair, in ‟British journal of surgery", 1972, LIX, pp. 617-622.
Best, J. W., Angelo, J. J., Milligan, B., Complete traumatic amputation of the penis, in ‟Journal of urology", 1962, LXXXVII, pp. 134-138.
Bunke, H. J. Jr., Toe digital transfer, in ‟Clinics in plastic surgery", 1976, III, pp. 1-15.
Bunke, H. J. Jr., Schulz, W. P., Experimental digital amputation and reimplantation, in ‟Plastic and reconstructive surgery", 1965, XXXVI, pp. 62-70.
Bunke, H. J. Jr., Schulz, W. P., Total ear reimplantation in the rabbit utilizing micro-miniature vascular anastomoses, in ‟British journal of plastic surgery", 1966, XIX, pp. 15-22.
Clagett, G. P., Salzman, E. W., Prevention of venous of thromboembolism in surgical patients, in ‟New England journal of medicine", 1974, CCXC, pp. 93-96.
Daniel, R. K., Taylor, G. I., Distant transfer of an island flap by microvascular anastomoses, in ‟Plastic and reconstructive surgery", 1973, LII, pp. 111-117.
Daniel, R. K., Williams, H. B., The free transfer of skin flaps by microvascular anastomoses, in ‟Plastic and reconstructive surgery", 1973, LII, pp. 16-31.
Elcock, H. W., Fredrickson, J. M., The effect of the heparin on thrombosis at microvenous anastomotic sites, in ‟Archives of otolaryngology", 1972, XCV, pp. 68-73.
Fujikawa, S., O'Brien, B. M., An experimental evaluation of microvenous grafts, in ‟British journal of plastic surgery", 1975, XXVIII, pp. 244-246.
Gilbert, A., O'Brien, B. M., Vorrath, J. W., Sykes, P. J., Baxter, T. J., Lymphaticovenous anastomosis by microvascular technique, in ‟British journal of plastic surgery", 1976, XXIX, pp. 355360.
Ham, J. M., Slack, W. W., Platelet adhesiveness after operation, in ‟British journal of plastic surgery", 1967, LIV, pp. 385-389.
Hayhurst, J. W., Factors influencing patency rates, in Symposium on microsurgery, St. Louis 1967.
Hayhurst, J. W., O'Brien, B. M., An experimental study of microvascular technique, patency rates, and related factors, in ‟British journal of plastic surgery", 1975, XXVIII, pp. 128-132.
Hayhurst, J. W., O'Brien, B. M., Ishida, H., Baxter, T. J., Experimental digital replantation after prolonged cooling, in ‟the hand", 1974, VI, pp. 134-141.
Henderson, P. N., O'Brien, B. M., Parel, J. M., An adjustable double microvascular clamp, in ‟Medical journal of Australia", 1970, I, pp. 715-717.
Jacobson, J. H., Suarez, E. L., Microsurgery in anastomosis of small vessels, in ‟Surgical forum", 1960, XI, pp. 243-245.
Kolàř, L., Wieberdink, J., Reneman, R. S., Anticoagulation in microvascular surgery, in ‟Current surgical research", 1963, V, pp. 52-57.
Lendvay, P. G., Replacement of the amputated digit, in ‟British journal of plastic surgery", 1973, XXVI, pp. 398-405.
Leonard, E. F., The role of flow in thrombogenesis, in ‟Bulletin of the new York Academy of Medicine", 1963, XLVIII, pp. 273-280.
May, W. J., Bunting, P. D., Trsferimento libero di digiuno per la ricostruzione dell'esofago irradito, in Microchirurgia ricostruttiva (a cura di K. D. Rollin e J. K. Terzis), Torino 1981, pp. 29-235.
Millesi, H., Brachial plexus injuries, in ‟Clinics in plastic surgery", 1984, XI, pp. 115-120.
Millesi, H., Nerve grafting, in ‟Clinics in plastic surgery", 1984, XI, pp. 105-113.
Morelli, E., Treatment and evaluation of nerve injuries at the wrist and the hand, in ‟Orthopaedica italica", 1972, I, 2, pp. 190-202.
Morelli, E., Sindromes comprensivos canaliculares, in ‟Revista de medicina de la Universidad de Navarra", 1980, XXIV, 1, pp. 43-50.
Morelli, E., Trattamento precoce delle paralisi ostetriche, in 82° congresso degli Archivi della Società Italiana di Chirurgia, Milano 1980, pp. 970-971.
Morelli, E., Raimondi, P. L., I lembi liberi di omento nel trattamento delle paralisi post-attiniche del plesso brachiale, in ‟Il chirurgo", 1983, II, 2, pp. 76-79.
Morelli, E., Raimondi, P. L., Saporiti, E., Le paralisi ostetriche. Il loro trattamento microchirurgico precoce, in Le paralisi ostetriche (a cura di F. Pipino), Bologna 1984, pp. 57-76.
Negus, D., Pinto, D. J., Slack, W. W., Effect of small doses of heparin on platelet adhesiveness and lipoprotein lipose activity before and after surgery, in ‟Lancet", 1971, I, pp. 1202-1204.
Nylén, C.O., The microscope in aural surgery, its first use and later development, in ‟Acta otolaryngology", 1954, suppl. 116, pp. 226-240.
Nylén, C. O., The otomicroscope and microsurgery 1921-1971, in ‟Acta otolaryngology", 1972, LXXIII, pp. 453-454.
O'Brien, B. M., A modified triploscope, in ‟British journal of plastic surgery", 1973, XXVI, pp. 301-303.
O'Brien, B. M., Microvascular reconstructive surgery, Edinburgh-New York 1977 (tr. it.: Microchirurgia vascolare ricostruttiva, Padova 1980).
O'Brien, B. M., Hayhurst, J. W., Metallized microsuturs and the new micro needle holder, in ‟Plastic and reconstructive surgery", 1973, LII, pp. 673-676.
O'Brien, B. M., MacLeod, A. M., Miller, G. D. H., Newing, R. K., Hayhurst, J. W., Morrison, W. A., Clinical replantation of digits, in ‟Plastic and reconstructive surgery", 1973, LII, pp. 490-502.
O'Brien, J. R., Tulevski, V. G., Etherington, M., Madgwick, T., Alkjaersig, N., Fletcher, A., Platelet function studies before and after operation and the effect of postoperative thrombosis, in ‟Journal of laboratory and clinical medicine", 1974, LXXXII, pp. 342-354.
Perrit, R. A., Recent advances in corneal surgery, in ‟American Academy of Ophthalmology and Otolaryngology", 1950, course nr. 280.
Petrolati, M., Raimondi, P. L., Obstetric plexus palsy: early microsurgical treatment, in CRC handbook of microsurgery (a cura di W. Olszewski), Boca Raton, Fla., 1984, pp. 201-217.
Raimondi, P. L., Cavallazzi, R., Morelli, A., Petrucci, F. S., Ventura, O., La sindrome compressiva del nervo interosseo posteriore alla arcata di Fröse, in ‟Rivista di chirurgia della mano", 1979, XVI, 2, pp. 237-242.
Raimondi, P. L., Petrolati, M., Morelli, A., Surgical management of traumatic plexus injuries: considerations and results, in Transactions of the VII international congress of plastic and reconstructive surgery. Rio de Janeiro, May 20-25, 1979 (a cura di I. Fonseca Ely), Rio de Janeiro 1979, pp. 95-98.
Salimbeni-Ughi, G., Evaluation of results in 36 cases of facial palsy treated with nerve grafts, in ‟Annals of plastic surgery", 1982, IX, pp. 36-41.
Santoni-Rugiu, P., Il reimpianto di dita amputate con tecnica microchirurgica, in ‟Rivista italiana di chirurgia plastica", 1976, VIII, pp. 163-169.
Santoni-Rugiu, P., I lembi liberi microvascolari, in Atti del congresso ‛3 giornate italiane del fissatore esterno', Mestre 1979, pp. 381-393.
Santoni-Rugiu, P., Review of 33 free groin flaps in the repair of complicated defects of the lower limb, in ‟Annals of plastic surgery", 1982, IX, pp. 10-17.
Santoni-Rugiu, P., Massei, A., Ubiglia, G. P., Pastacaldi, P., Considerazioni anatomo-cliniche sui lembi liberi inguinoaddominali con microanastomosi vascolari, in ‟Minerva chirurgica", 1977, XXXII, pp. 987-1000.
Santoni-Rugiu, P., Salimbeni, G., Pastacaldi, P., Stellini, F., Esperienze sul trasferimento di lembi liberi cutaneo-adiposi con microanastomosi vascolari, in ‟Minerva chirurgica", 197, XXXII, pp. 979-985.
Santoni-Rugiu, P., Salimbeni-Ughi, G., Sykes, P. J., Massei, A., The use of free microvascular flaps in the leg. Their value in orthopaedic surgery, in ‟Archives of orthopaedic and traumatologic surgery", 1979, XCIII, pp. 201-205.
Schulman, M. L., Renastomosis of the amputated penis, in ‟Journal of urology", 1973, CIX, pp. 432-434.
Sulianegara, R., O'Brien, B. M., Ryan, P. J., Pianta, R. M., Experimental replacement of the cervical oesophagus with a free transverse colon autograft using microvascular anastemoses, in ‟Australian and New Zealand journal of surgery", 1978, XLVIII, 4, pp. 463-469.
Taylor, G. I., Miller, G. D. H., Ham, F. J., The free vascularized bone graft, in ‟Plastic and reconstructive surgery", 1975, V, pp. 533-544.
Ts'ui, C., Feng, Y. H., Tange, C. Y., Li, C. M., Yu, Y. C., Ch'en, C. C., Shih, Y. F., Wang, W. H., Chiang, L. P., Ch'iu, H. P., Ma, S. H., Lin, T. L., Ch'en, C., Microvascular anastomosis and transplantation: experimental studies and clinical application, in ‟Chinese medical journal", 1966, LXXXV, pp. 610-616.
Verzella, F., Microchirurgia della lente nella miopia elevata, in ‟Sanità telex", 1983, V, 84, pp. 32-39.
© Istituto della Enciclopedia Italiana - Riproduzione riservata