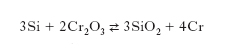Cromo
Enciclopedia on line
Elemento chimico, di simbolo Cr, numero atomico 24, peso atomico 52, di cui sono noti gli isotopi stabili 5024Cr, 5224Cr, 5324Cr e 5424Cr; appartiene al sesto gruppo del sistema periodico degli elementi, sottogruppo del molibdeno e del tungsteno; fu scoperto nel 1797 da L.- N. Vauquelin.
Generalità
Il c. è un metallo grigio splendente, molto duro, che cristallizza nel sistema cubico; fonde a circa 1875 °C, bolle a 2672 °C; ha densità 7,2 g/cm3. Forma composti nei quali si comporta da bi-, tri- ed esavalente; alla temperatura ordinaria non si ossida neanche all’aria umida; si passiva facilmente e in tale forma è inattaccabile o quasi dagli acidi concentrati; si scioglie facilmente negli acidi cloridrico, solforico ecc., diluiti, sviluppando idrogeno e dando soluzioni di sali cromosi, colorate intensamente in blu, che però, lasciate all’aria, assorbono ossigeno e si trasformano in soluzioni di sali cromici, colorate in verde. Si combina direttamente con diversi elementi (ossigeno, azoto, carbonio, silicio, boro, alogeni ecc.).
In natura il c. non si trova mai allo stato libero ma soltanto allo stato di combinazione, principalmente sotto forma di cromite, che rappresenta il solo minerale impiegato per l’estrazione del metallo. Appartiene al gruppo degli spinelli, di colore bruno scuro o nero ferro, con lucentezza metallica, spesso debolmente magnetico. È costituita da ossido di ferro e cromo, FeCr2O4, monometrico. Non di rado il ferro è sostituito in percentuali variabili dal magnesio e il c. dall’alluminio. Si trova generalmente in masse granulari. Commercialmente si distinguono tre tipi di cromite: quella per uso metallurgico, in pezzi duri, ha contenuto di ossido di c. superiore al 48% e con rapporto Fe/Cr dell’ordine di 3:1; quella per refrattari è caratterizzata da un contenuto elevato di ossido di c. e di alluminio ma basso di ferro; quella per usi chimici ha elevato contenuto di ossido di cromo, ma basso tenore di alluminio e di silice.
Processi di produzione
I processi industrialmente importanti per la produzione del c. sono quelli silicotermico e alluminotermico (il primo a essere realizzato su larga scala), dai quali il c. si ottiene sotto forma di lega ferro-c., e i processi elettrolitici.
Processo silicotermico. - Nel processo silicotermico si compie la riduzione del sesquiossido di c. con silicio secondo la reazione
La reazione viene condotta all’interno di un forno elettrico e in presenza di ossido di calcio che serve per la scorificazione della silice. Il sesquiossido di c. impiegato nella preparazione del metallo secondo i processi silicotermico e alluminotermico, si ottiene dalla cromite fondendola con alcali, lisciviando il cromato con acqua, trasformandolo in bicromato e, infine, riducendo questo a ossido per fusione con zolfo.
Processi elettrolitici. - Dei procedimenti elettrolitici, che sono gli unici in grado di dare un metallo con purezza al 99,8% o più (come è spesso richiesto quando il c. è usato come alligante nella fabbricazione di acciai speciali e di leghe), due risultano particolarmente diffusi. L’uno utilizza come materia prima la comune ferrolega di c. e, attraverso numerosi stadi di lisciviazione, precipitazione e purificazione, perviene a una soluzione pura di allume di c. (cioè un solfato doppio di c. e ammonio), sulla quale si effettua l’elettrolisi in speciali celle con rese di corrente del 50% circa. L’altro procedimento parte direttamente dalla cromite e, sempre con più stadi di lisciviazione e purificazione, giunge a una soluzione cromica acida con costi molto minori; l’elettrolisi di questa soluzione, però, comporta rendimenti di corrente molto modesti, dell’ordine del 10%. Il metallo che si ottiene dall’elettrolisi delle soluzioni di acido cromico ha caratteristiche migliori rispetto a quella ottenibile dalle soluzioni di allume di c. (meno impurezze, specie ferro, meno ossigeno, meno gas disciolti).
Impieghi
Il c. è impiegato nella cromatura e come metallo per leghe. La cromatura consiste nel ricoprire con un sottile strato di c. superfici metalliche, a scopo protettivo contro la corrosione causata dagli agenti atmosferici, per conferire alla superficie durezza e resistenza alle usure più elevate e per migliorare l’aspetto estetico generale dell’oggetto. Si effettua per elettrodeposizione (galvanostegia o galvanoplastica), sopra oggetti accuratamente puliti e spesso preventivamente nichelati. Il bagno di cromatura è costituito da anidride cromica, CrO3, con aggiunta di sali aventi la funzione di conduttori, mentre gli anodi sono costituiti da una lega piombo-antimonio. Gli impianti devono essere muniti di aspiratori per la rapida evacuazione dei vapori di anidride cromica, assai pericolosi per l’integrità della pelle e delle vie respiratorie. La cromatura oltre ai requisiti già detti che la rendono ormai indispensabile in moltissime applicazioni di uso comune, riesce utilissima sia per apparecchiature industriali destinate alle lavorazioni di materie plastiche, essendo nulla l’aderenza di queste a superfici cromate, sia per organi e macchinari funzionanti alle alte temperature ai quali conferisce una elevata inossidabilità.
Le leghe di c. sono di diversi tipi: l’aggiunta di c. agli acciai, fino al 3% circa, ne migliora la temprabilità; quelle che contengono anche altri metalli (Ni, Mn, Y) presentano elevate resistenze, aggiunte agli acciai di c. dell’ordine del 5-6% fanno aumentare la resistenza alla corrosione e all’ossidazione. Gli acciai inossidabili contengono dal 10 al 18% di c.; alcuni tipi contengono anche nichel. Il c. entra pure nella preparazione di leghe di cobalto (per aumentarne la durezza, la resistenza alla corrosione), di nichel per applicazioni elettriche ecc.
Il c. viene anche utilizzato nella fabbricazione di mattoni refrattari che presentano grande resistenza alla pressione e alle temperature elevate, usati nei rivestimenti dei forni industriali. I sali di c. trovano impiego come pigmenti, come agenti concianti, come mordenti in tintoria, nella fotografia a colori, in ceramica ecc. In terapia si usano l’ anidride cromica e il bicromato di potassio per applicazioni esterne, come caustici (per condilomi, callosità, verruche ecc.) o come astringenti (gengiviti). L’assorbimento dei composti di c. provoca lesioni renali degenerative con albuminuria e glicosuria, diarrea e vomito.
Composti
Idrossido di c. Ha formula Cr(OH)3, si ottiene precipitando a caldo la soluzione di un sale di c. con una base. Allo stato secco è una polvere amorfa verde-grigia; è solubile negli acidi con formazione dei sali di c. e negli alcali forti con formazione di cromiti. Si impiega per la preparazione di composti solubili del c., in particolare nell’industria conciaria. Sesquiossido di c. Ossido del c. trivalente, di formula Cr2O3. Polvere amorfa, di colore verde scuro opaco (è anche detto verde di c.), che per riscaldamento cristallizza in cristalli esagonali; è inattaccabile dalle soluzioni alcaline e dagli acidi diluiti. È alla base della produzione di c. mediante il processo silicotermico. Viene altresì impiegato come pigmento in vetreria, in ceramica, nella stampa di biglietti di banca, come catalizzatore, specie insieme a ossido di rame (sintesi del metanolo, ciclizzazione degli idrocarburi ecc.). Acido cromico L’ossido cromico Cr2O3 si comporta in realtà come l’anidride di un acido molto forte, simile all’acido solforico. I corrispondenti sali, o cromati Me2 CrO4, essendo Me un metallo monovalente, sono gialli, isomorfi con i solfati. Quelli dei metalli alcalini, del calcio e del magnesio sono molto solubili. È nota una serie di policromati, analoghi a quelli di tungsteno e molibdeno, di composizione generale Me2Cr2O7 ( bicromati), Me2Cr3O10 ( tricromati) e Me2Cr4O13 ( tetracromati).
© Istituto della Enciclopedia Italiana - Riproduzione riservata