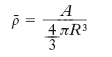Nucleo
Enciclopedia on line
Genericamente, la parte centrale di qualche cosa, in quanto appaia più compatta di ciò che la circonda, o perché si consideri come primo elemento di formazione intorno a cui altri elementi si siano raccolti e organizzati.
Anatomia
N. di un organo è la porzione centrale e ben delimitata, che si distingue dai tessuti circostanti per caratteristiche strutturali (per es., n. polposo del disco intervertebrale; n. centrale della prostata).
Nel sistema nervoso centrale il termine n. è riservato a particolari gruppi di cellule nervose ben delimitati e connessi con determinate funzioni. I principali n. encefalici sono: il n. ambiguo, situato nel midollo allungato, dà origine a una parte delle fibre motrici dei nervi glossofaringeo, vago e accessorio o spinale; il n. caudato, situato in prossimità del ventricolo laterale, fa parte del corpo (➔) striato; il n. di Edinger-Westphal, situato nel mesencefalo, fa parte del parasimpatico ed è connesso con la motilità della pupilla (centro pupillo-costrittore). Il n. motorio del nervo facciale è situato nella protuberanza anulare al confine con il midollo allungato; il n. sensitivo è rappresentato da una parte del n. del tratto solitario. Il n. sensitivo del nervo trigemino è situato nella porzione laterale del midollo allungato e nella parte inferiore della protuberanza anulare (n. sensitivo principale); si continua nel mesencefalo (n. mesencefalico del trigemino) lateralmente all’acquedotto di Silvio, e verso il basso nel midollo spinale (n. spinale del trigemino); il n. motorio (o masticatorio) è situato nella profondità della protuberanza in corrispondenza della calotta. Il n. sensitivo del nervo vago corrisponde alla porzione inferiore del n. del tratto solitario; il n. motorio è situato nel pavimento del IV ventricolo, in corrispondenza dell’ala cinerea (n. motorio dorsale del vago), ma una parte delle fibre efferenti trae origine dal n. ambiguo. Il n. del nervo vestibolare è situato nel midollo allungato e suddiviso in n. di Bechterev, n. di Deiters e n. vestibolare propriamente detto, che corrisponde all’ala bianca esterna del pavimento del IV ventricolo. Il n. paraventricolare dell’ipotalamo è situato nella porzione anteriore dell’ipotalamo, sopra il chiasma dei nervi ottici, a ridosso della parete del III ventricolo. Il n. rosso o di Stilling è situato nella parte anteriore della calotta del peduncolo cerebrale; ha forma rotondeggiante ed è costituito da cellule pigmentate; fa parte del sistema extrapiramidale ed è in rapporto diretto con il n. dentato del cervelletto e con l’oliva inferiore. Il n. sopraottico, nella regione anteriore dell’ipotalamo, è disposto a ridosso del chiasma dei nervi ottici e della zona contigua del tratto ottico. Il n. del tratto solitario è un n. sensitivo, situato nel midollo allungato; riceve le fibre dei nervi glossofaringeo e vago.
Astronomia
La parte più luminosa di una cometa e anche la stella eccitatrice al centro di una nebulosa planetaria.
In geofisica e astronomia, la porzione centrale del globo terrestre (➔ Terra), di altri corpi celesti (pianeti, stelle) o di sistemi di corpi celesti (galassie).
Biologia
Il n. è un costituente essenziale delle cellule eucariotiche. Di regola unico e sferico o ellissoidale, può essere allungato, lenticolare, lobato, duplice, molteplice ecc.: nelle cellule del fegato, della cartilagine ialina si hanno spesso due nuclei; polinucleati sono anche gli osteoclasti e i megacariociti del midollo osseo. Il n. può mancare nel periodo finale della vita di alcune cellule, come gli eritrociti dei Mammiferi. Le dimensioni del n. interfasico sono proporzionali a quelle della cellula.
Struttura
Il citoplasma di una cellula non può crescere indefinitamente; quando esso raggiunge un certo volume, la cellula si divide. Esiste infatti un rapporto nucleoplasmatico fra il volume del n. e il volume totale della cellula, costante per tutte le cellule di una data specie animale o vegetale (legge di Hertwig-Boveri).
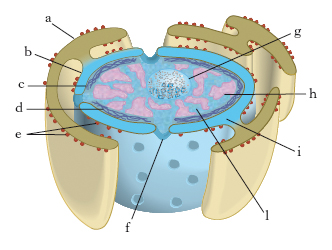
In tutte le cellule, a eccezione di quelle dei procarioti, il n. è separato dal citoplasma da una membrana nucleare (fig. 1), determinata da un differenziamento locale del reticolo endoplasmico, ed è costituito da un nucleoplasma o succo nucleare, di aspetto omogeneo, nel quale sono immersi uno o più corpuscoli tondeggianti molto rifrangenti che corrispondono a uno o più nucleoli. Si distinguono inoltre nel nucleoplasma masse più dense che costituiscono la cromatina (➔). Sia il nucleolo sia la cromatina sono immersi direttamente nel nucleoplasma e non sono delimitati da una membrana, come altri organelli citoplasmatici.
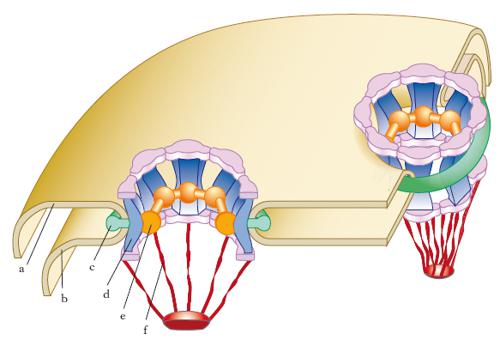
A partire dalla seconda metà del 1980, l’uso di marcatori e lo sviluppo di tecnologie molecolari ha permesso di comprendere più approfonditamente sia la struttura sia la funzione della membrana nucleare, che appare formata da due membrane concentriche separate da uno spazio intermembrana di 10-30 nm e interrotte a intervalli dai pori nucleari (➔ lamina). Tramite la membrana nucleare avviene il passaggio di molecole dirette da e verso il nucleo. Questo ‘traffico’ bidirezionale si verifica attraverso i pori nucleari, il cui diametro è compreso tra 60 e 90 nm e il cui numero differisce a seconda del tipo di cellula e della specie, variando da 1 a 100 per nm2 di superficie nucleare; il numero complessivo dei pori varia anche nel corso del ciclo di sviluppo e, generalmente, è correlato all’entità della sintesi nucleare di RNA. Ciascun poro è formato da una complessa struttura dotata di simmetria radiale e bilaterale, costituita da più di 100 diverse proteine (fig. 2). In sezione il complesso del poro nucleare appare composto da tre parti: una componente a colonna, che forma la parete del poro; una componente anulare, costituita da 8 granuli da ciascuno dei quali si estende un raggio che converge con gli altri a delimitare l’apertura effettiva del canale del poro, la quale ha un diametro di circa 9 nm; una componente luminale, che sporge nello spazio perinucleare ed è costituita da 25 molecole di una glicoproteina transmembrana (gp210), che ha il ruolo di ancorare il complesso del poro alle membrane. Mediante l’uso di marcatori è stato possibile dimostrare che, attraverso il canale di 9 nm di diametro del complesso del poro, avviene la diffusione passiva di piccole molecole solubili in acqua. Le proteine di alto peso molecolare (gli istoni o le RNA-polimerasi) sono invece trasportate nel n. in modo selettivo mediante trasporto attivo. L’assunzione selettiva di queste macromolecole è dovuta a sequenze di amminoacidi, con funzione di segnale di localizzazione nucleare, presenti solo nelle proteine che devono essere trasportate nel nucleo. Esse sono tipicamente costituite da 448 amminoacidi, fra i quali si trovano spesso sia la prolina sia amminoacidi carichi positivamente, quali l’arginina e la lisina. Nel trasporto attraverso la membrana nucleare la macromolecola si lega alle proteine del complesso del poro e successivamente è inserita all’interno del n. con un processo che richiede energia, cioè idrolisi di ATP. Il processo di trasporto delle macromolecole attraverso i pori nucleari, mediato da proteine, è diverso dai processi di trasporto attraverso le membrane plasmatiche: le proteine nucleari sono trasportate in una conformazione tridimensionale mentre, a livello delle altre membrane, una classe di chaperonine (➔) coadiuva lo svolgimento delle proteine per permettere loro di attraversare in forma lineare la membrana idrofobica; inoltre i segnali di indirizzo nucleare sono caratteristiche permanenti delle proteine nucleari, diversamente dai segnali che mediano il trasporto delle proteine della membrana e del reticolo endoplasmatico, che sono rimossi dopo il trasporto.
Il nucleolo è un corpo rotondeggiante presente nel n. cellulare in interfase. Scompare quasi sempre all’osservazione durante il processo della mitosi e si riforma al termine di questo. Nei preparati fissati e colorati appare omogeneo, privo di involucro delimitante e si colora intensamente con i coloranti basici. Non si colora con la reazione di Feulgen, che è la reazione istochimica specifica del DNA. Il nucleolo contiene RNAr, proteine e fosfoproteine e risulta costituito, all’indagine al microscopio elettronico, di numerosi granuli e di sottili filamenti aggregati fra loro. L’RNAr è trascritto dall’organizzatore nucleolare, cioè da un gruppo di geni ripetuti che sono localizzati a livello delle costrizioni secondarie di alcuni cromosomi, detti cromosomi nucleolari. I precursori ribosomici sintetizzati nel nucleolo passano nel citoplasma costituendo i ribosomi che presiedono alla sintesi proteica della cellula.
Funzioni e chimica del nucleo
Il citoplasma è la sede di tutte le funzioni vitali della cellula (assorbimento, respirazione, glicolisi, processi di sintesi, movimento, contrattilità, irritabilità) e sicuramente interviene nella regolazione dell’attività dei geni. La funzione fondamentale del n. è invece quella di depositario dei caratteri ereditari e vi avviene la duplicazione del DNA. Inoltre esso assolve il compito fondamentale di dirigere e controllare le funzioni citoplasmatiche (sintesi di proteine strutturali, di proteine di secrezione, di enzimi) sulla base delle informazioni genetiche iscritte nell’acido desossiribonucleico dei cromosomi. Le informazioni portate dal DNA vengono trasmesse al citoplasma tramite le molecole dell’RNAm. Gli RNAm trascritti lasciano il n. e passano nel citoplasma; la loro lettura tramite i ribosomi permette la sintesi di proteine specifiche.
La quantità di DNA contenuta in ciascun n., costante per tutti i tessuti di una specie, in media è di 2,5×10–9 mg; i gameti hanno un contenuto di DNA corrispondente alla metà di questo valore. L’RNA presente nel n. è in quantità variabile e rappresenta in media dal 5% al 10% dell’RNA totale della cellula. La cromatina nel n. è costituita da proteine basiche, gli istoni, che si legano al DNA per formare le unità di base della cromatina, i nucleosomi (➔ istoni). Nei n. degli spermatozoi le proteine basiche sono rappresentate invece da protammine. Le proteine acide, a differenza degli istoni, si rinnovano rapidamente e sono molto abbondanti nelle cellule che hanno un attivo metabolismo; sono assenti negli spermatozoi.
Botanica
N. primario
Il n. della macrospora fertile nell’ovulo delle Fanerogame. N. secondario Il n. diploide, originato dalla fusione di due n. aploidi nel sacco embrionale delle Angiosperme (➔ embrione).
Fisica
N. atomico
Il corpuscolo, carico positivamente, di dimensioni dell’ordine di 10–14 m, che costituisce la parte centrale di ogni atomo. Lo studio delle proprietà dei n. forma l’argomento della fisica nucleare (➔ nucleare).
Numero atomico e numero di massa
Un n. è caratterizzato da due numeri interi, che rappresentano, in opportune unità, la sua carica elettrica e la sua massa. Il primo è il numero atomico Z, che coincide con il numero d’ordine del corrispondente elemento chimico nel sistema periodico degli elementi; indicando con e il valore assoluto della carica elettrica (negativa) dell’elettrone, il prodotto +Ze rappresenta la carica elettrica positiva del n. considerato. Il secondo è il numero di massa A, che è il numero intero che approssima nel modo migliore la massa del n., espressa in unità di massa atomica (per il n. di idrogeno, o protone, si ha A=1). Nuclide è la singola specie nucleare, individuata dal numero atomico Z e dal numero di massa A.
Poiché in un atomo neutro il n. è contornato da Z elettroni, che con la loro carica complessiva, −Ze, compensano esattamente la carica positiva del n., due nuclidi, dotati dello stesso numero atomico Z, ma di diversi numeri di massa, prendono il nome di nuclidi isotopi in quanto i corrispondenti atomi appartengono allo stesso elemento chimico e pertanto occupano la stessa casella (o posto) del sistema periodico degli elementi; essi hanno proprietà chimiche pressoché eguali. Due nuclidi dotati dello stesso numero di massa A, ma di diverso numero atomico Z, prendono il nome di nuclidi isobari; essi appartengono a due diversi elementi chimici ma hanno masse pressoché eguali. L’atomo di un elemento X, il cui n. sia caratterizzato da certi valori di Z e A, viene indicato con il simbolo AZX; per es. 2713Al. I due numeri Z e A acquistano un altro semplice e fondamentale significato nel quadro delle conoscenze sulla costituzione dei n.: questi ultimi sono aggregati di Z protoni e N=A−Z neutroni. Poiché il protone e il neutrone sono due stati di un unico ente, il nucleone, si può anche dire che il numero di massa A è il numero dei nucleoni costituenti un n. e che il numero atomico Z indica quanti di questi nucleoni sono protoni. Due n. isotopi sono quindi costituiti dallo stesso numero di protoni ma da un numero diverso di neutroni; due n. isobari sono invece costituiti dallo stesso numero di nucleoni, ma da un numero diverso di protoni e di neutroni.
Gli A nucleoni che costituiscono un n. sono tenuti insieme da forze, dette forze nucleari, che agiscono fra tutte le coppie di nucleoni e in generale prevalgono sulla repulsione coulombiana che si esercita fra tutte e sole le coppie di protoni: esse sono circa 1000 volte più intense della forza coulombiana quando i due nucleoni interagenti sono a una distanza r dell’ordine di (1-2)∙10−15 m, ma decrescono così rapidamente al crescere di r da essere praticamente eguali a zero per r>(3-4)∙10−15 m; si tratta, dunque, di forze a breve raggio di azione. Le forze coulombiane invece, pur essendo più deboli, decrescono così lentamente al crescere di r da far sentire il loro effetto anche a distanze assai maggiori (esse sono forze a lungo raggio di azione).
La scoperta del n. e le sue dimensioni spaziali
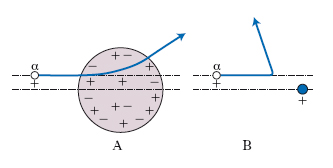
La scoperta del n. fu fatta nel 1911 da E. Rutherford sulla base dei risultati sperimentali di una celebre esperienza eseguita su suo suggerimento da H. Geiger e E. Marsden. Era già allora chiaro che ogni atomo deve necessariamente essere costituito, oltre che da un certo numero di elettroni, anche da uno o più corpuscoli carichi positivamente, la cui massa complessiva deve essere molto più grande di quella degli elettroni. J.J. Thomson aveva proposto un modello di atomo consistente in una sfera di dimensioni dell’ordine di quelle dell’atomo stesso (∼10−10 m), entro la quale la carica positiva sarebbe stata distribuita uniformemente; entro questa sfera positiva avrebbero dovuto essere immersi gli elettroni, i cui moti risultavano simili a quelli di altrettanti oscillatori armonici tridimensionali. Rutherford, nel 1911, propose, in alternativa al modello di Thomson, un modello di atomo, detto in seguito modello di Rutherford, nel quale tutta la carica positiva e la quasi totalità della massa sono concentrate in un corpuscolo di dimensioni enormemente più piccole di quelle dell’atomo stesso, corpuscolo che Rutherford chiamò n., e attorno al quale si muovono tanti elettroni quanti sono necessari per compensarne esattamente la carica. Questo modello gli fu suggerito dalla diffusione a grande angolo subita dalle particelle α emesse da sostanze radioattive nell’interazione con atomi pesanti, spiegabile solo assumendo che la parte massiva carica positivamente dell’atomo sia concentrata in una regione di spazio molto più piccola delle dimensioni dell’atomo stesso (una particella α, avendo una massa circa 10 volte maggiore di quella degli elettroni, praticamente non risente delle azioni di questi ultimi). Nella fig. 3 è mostrato schematicamente un confronto fra le deflessioni calcolate per una particella α, dotata di ben determinate condizioni iniziali di moto, nel caso che valga l’uno o l’altro dei due modelli.
Anche successive e più accurate esperienze sulla diffusione delle particelle α da parte di atomi pesanti diedero risultati in accordo perfetto con il modello di Rutherford e in disaccordo completo con quello di Thomson. Per quanto riguarda le dimensioni del n., nel 1925 E. Rutherford e J. Chadwick riuscirono a stabilirne l’ordine di grandezza: eseguendo esperienze con particelle α di energia più grande, in modo che esse, vincendo la repulsione coulombiana, potessero giungere a distanze più brevi dal centro del n., e misurando quelle deflesse ad angoli molto elevati, stimarono che le dimensioni del n. dovevano essere dell’ordine di 10−14 m. Da misurazioni di questo stesso tipo, e da altre successive, si sa che se si immagina che il n. sia descrivibile come una sfera omogenea e isotropa di raggio R, vale la relazione empirica, grossolana, ma fondamentale in quanto fornisce sempre il giusto ordine di grandezza
formula [1] ,
dove r0≃1,2∙10−15 m. Tale formula contiene un risultato fondamentale sulla struttura del n.: la densità media dei nucleoni del n., cioè il rapporto
formula [2]
è indipendente da A e vale 3/(4πr30). In altre parole, il numero di nucleoni contenuti nell’unità di volume rimane pressoché lo stesso al variare di A da poche unità a circa 250. Questa proprietà generale dei n. viene indicata come saturazione della densità.
Distribuzione spaziale dei protoni e dei neutroni nel nucleo
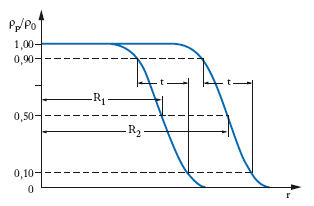
La [1] è stata dedotta da esperienze di urto di particelle α (o altre particelle, come i neutroni o i protoni) nell’ipotesi che un n. sia una sfera omogenea e isotropa. Questa descrizione è certamente troppo grossolana: è chiaro infatti che nella regione superficiale di un n. la densità ρ dei nucleoni deve decrescere, con una certa gradualità, dal valore che essa ha nella regione centrale fino a zero. Una chiara indicazione in questo senso si ricava dalle esperienze di urto di elettroni di elevata energia (alcune centinaia di MeV) contro n., simili a quelle usate per lo studio della struttura dei nucleoni. In fig. 4 è dato l’andamento in funzione di r (distanza dal centro del n.) del rapporto ρp/ρ0, ricavato dalla:
formula [3]
dove ρp è la densità dei protoni e a0=t/4,40, essendo t lo spessore dello strato ;superficiale del nucleo. Il parametro ρ0 è una costante di normalizzazione, il cui valore si determina imponendo che l’integrale di ρp esteso a tutto lo spazio sia eguale al numero totale dei protoni presenti nel n.; i valori di R ricavati in tal modo soddisfano discretamente bene la [1], ove si assuma r0=1,07∙10−15 m, mentre a0 risulta pressoché indipendente da A e pari a 5,45∙10−16 m; resta così confermato, anche da questo punto di vista un poco più raffinato, che nei n. si ha la saturazione della densità.
Energia di legame e stabilità dei nuclei
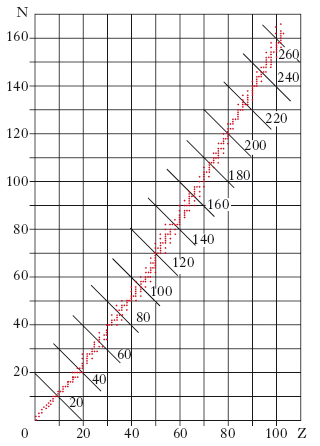
Come si è detto, ogni nuclide è specificato dai valori dei due numeri interi Z e A, o, che è lo stesso, Z e N; è naturale porsi il problema di stabilire se esista o meno una relazione fra i valori di Z e N che competono ai nuclidi che si osservano in natura, la stragrande maggioranza dei quali è stabile o, per lo meno, così debolmente instabile da essere sopravvissuti attraverso le ere geologiche. Una simile relazione può essere cercata riportando lungo due assi cartesiani i valori di Z e N, e segnando un punto di corrispondenza di ciascun nuclide osservato in natura. Si ottiene così il diagramma della fig. 5, dal quale risulta che i nuclidi stabili (o quasi stabili) sono distribuiti in una regione assai ristretta di coppie di valori (Z, N); si potrebbe quasi dire che essi sono distribuiti lungo una curva in questo piano. La massa M di questi nuclidi, può essere pensata come una funzione M(Z, N) dei due numeri interi Z, N. L’esperienza mostra che essa non è mai eguale alla somma M′ delle masse dei nucleoni ed elettroni componenti l’atomo considerato
[4] M′ = Zmp + Nmn + Zme,
ma è sempre un poco minore. La differenza fra il valore M′ dato dalla [4] e la massa effettivamente misurata, M(Z, N), moltiplicata per c2 (c=3∙108 m/s è la velocità della luce nel vuoto), cioè
[5] B(Z,N)=[Zmp+Nmn+Zme−M(Z,N)]c2,
rappresenta l’energia di legame del nuclide specificato dai valori di Z e di N, ossia l’energia che è necessario fornire al nuclide per decomporlo in tutti i suoi A=Z+N nucleoni, lasciando questi fermi e a distanza infinita uno dall’altro. I valori di B(Z, N) che si trovano introducendo nella [5] i valori misurati (con lo spettrometro di massa) di M(Z, N), risultano, grosso modo, proporzionali al numero di massa A; ciò significa che il rapporto
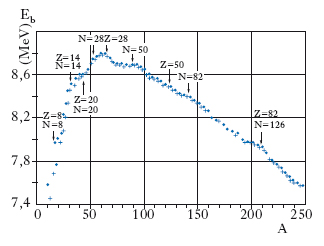
formula [6]
cioè l’energia di legame media per nucleone è pressoché indipendente da A. Questo importante risultato sperimentale viene indicato come saturazione dell’energia; esso infatti stabilisce che l’energia di legame media per nucleone è circa la stessa sia in un nuclide leggero sia in uno pesante. Le deviazioni da questa regola, grossolana ma fondamentale, sono mostrate nella fig. 6, ove sono riportati, in funzione di A, i valori di Eb, espressi in MeV/nucleone: come si vede, Eb varia da poco più di 7 MeV/nucleone a poco più di 9 MeV/nucleone; cioè, al variare di A da qualche unità a 250, Eb si mantiene pari a ∼8 MeV/nucleone, con uno scarto massimo del 10%. Molti nuclidi esistenti in natura sono instabili: alcuni emettono particelle α (n. di 42He), altri particelle β, ossia elettroni, di energia di qualche MeV (➔ radioattività); oltre a questi nuclidi radioattivi naturali, ve ne sono altri prodotti artificialmente, alcuni dei quali emettono elettroni mentre altri emettono positroni.
La condizione necessaria a cui deve soddisfare un nuclide per poter subire il processo di disintegrazione α (in cui sia Z sia N diminuiscono di due unità) è che il processo sia esoenergetico. Ciò comporta che la massa del corrispondente atomo deve soddisfare la disuguaglianza
[7] M(Z, N)>M(Z−2, N−2)+M(2, 2),
dove M(2, 2) è la massa dell’atomo di elio. Dall’esperienza sappiamo che si incontrano nuclidi radioattivi α solo fra gli elementi di numero atomico molto elevato (Z>80). La spiegazione è dovuta al fatto che la riduzione che subisce l’energia di legame B(Z, N) all’aumentare di A è dovuta alla repulsione coulombiana che si esercita fra tutte le coppie di protoni e che, al crescere di Z e A, cresce come Z2/A1/3. Solo da un certo valore di Z in su, essa è così forte da far sì che la diseguaglianza [7] possa essere soddisfatta. L’instabilità di un nuclide per emissione di elettroni o positroni è dovuta ai processi elementari
[8′] 10n → 11p + e− + ν̄e,
[8″] 11p → 10n + e+ + νe,
nel primo dei quali un neutrone (10n) si trasforma in un protone (11p), con emissione di un elettrone (e−) e un antineutrino (ν̄e), mentre nel secondo (che può aver luogo solo nel caso di un protone legato in un n.) si ha la trasformazione inversa, con emissione di un positrone (e+) e un neutrino (νe). Quando un nucleone appartenente a un nuclide subisce l’uno o l’altro dei processi [8], il numero di massa A rimane invariato: ciò significa che nel piano (Z, N) della fig. 5 l’emissione di un elettrone (positivo o negativo) corrisponde a uno spostamento lungo una linea isobarica (A=costante); nel caso dell’emissione di elettroni (processo [8′]), Z aumenta di 1, N diminuisce di 1; nel caso di emissione di positroni (processo [8″]), Z diminuisce di 1, N aumenta di 1. Da queste osservazioni segue la regola che se un nuclide instabile per emissione β ha un eccesso di neutroni rispetto ai nuclidi stabili, esso emette elettroni, mentre se esso ha un eccesso di protoni, emette positroni; nell’uno e nell’altro caso il corrispondente punto rappresentativo nel piano (Z, N) si sposta, lungo una linea isobarica, verso la regione dei n. stabili, scendendo così verso il fondo valle lungo l’uno o l’altro versante.
Momento angolare e momenti elettromagnetici del nucleo
Un n., al pari di qualsiasi altro sistema meccanico, possiede in generale un momento della quantità di moto rispetto al suo baricentro, o come si dice, un momento angolare intrinseco o spin (➔); il suo valore costituisce un’importante proprietà caratteristica di ogni nuclide nel suo stato fondamentale, che è stata misurata per tutti i nuclidi stabili e per molti nuclidi instabili. Si è trovato che, in accordo con quanto stabilisce la meccanica quantistica, tale momento è sempre eguale a un multiplo intero o semintero dell’unità quantistica h/2π, con h costante di Planck; espresso in questa unità, esso viene indicato con il simbolo I. In realtà, secondo la meccanica quantistica, il momento angolare (in unità ℏ) è un operatore vettoriale I, il quale gode di proprietà specifiche, fra cui ricordiamo le due seguenti: pensando di riferire questo vettore a una terna di assi, sono grandezze che possono essere misurate simultaneamente a) il valore di I2, che risulta sempre eguale a I(I+1), dove I è un numero intero o semintero; b) una sola delle sue tre componenti, diciamo Iz, la quale può assumere solo i (2I+1) valori I, I−1, ..., −I. In conclusione il vettore I fissa una direzione privilegiata nel n., la quale può assumere nello spazio solo (2I+1) diversi orientamenti rispetto a una direzione prefissata. Essendo costituito da A nucleoni in continuo movimento, Z dei quali sono carichi positivamente, è naturale attendersi che un nuclide, al pari di qualsiasi altro sistema di cariche elettriche in moto, possa in generale avere alcuni momenti elettrici e magnetici. È proprio l’esistenza di questi momenti elettromagnetici che rende possibile la misurazione del valore di I per ciascun nuclide nel suo stato fondamentale.
Un sistema qualsivoglia di cariche in moto, posto in un campo elettrico e in uno magnetico esterni, possiede un’energia di interazione con detti campi che dipende dalla carica elettrica totale q, dal momento elettrico di dipolo P, dal momento di dipolo magnetico M e dal momento elettrico di quadrupolo Q del sistema. Nel caso di un nuclide i campi esterni sono i campi generati dagli elettroni orbitanti attorno al n., ai quali si possono aggiungere eventuali campi introdotti ad hoc dallo sperimentatore. In assenza di questi campi aggiuntivi, l’interazione elettromagnetica fra la nuvola degli elettroni orbitali e il corrispondente n. dà luogo a un accoppiamento fra il momento angolare I del nuclide e il momento angolare totale J degli elettroni, i quali si compongono vettorialmente dando così luogo al momento angolare totale dell’atomo, F=J+I, al quale è associato un nuovo numero quantico F, che può assumere solo i valori I+J, I+J−1, ... I−J, che sono (2I+1) oppure (2J+1) a seconda che I sia minore o maggiore di J.
Ha così origine la struttura iperfina dei livelli atomici, ossia il fatto che un qualsiasi livello atomico caratterizzato da certi numeri quantici (fra i quali J) si divide in tanti livelli quanti sono i valori di F, ai quali competono energie lievemente diverse: essi costituiscono un multipletto della struttura iperfina. Questo fenomeno si osserva naturalmente solo se il nuclide dell’atomo considerato possiede un momento angolare I diverso da zero. Uno studio sistematico ha portato ai seguenti risultati generali: a) i nuclidi costituiti da un numero di nucleoni A pari hanno sempre I intero, quelli con A dispari hanno sempre I semintero; b) nessun n. possiede un momento elettrico di dipolo, in accordo con un teorema generale secondo il quale se un sistema di cariche ha un asse di simmetria e il baricentro delle cariche che lo compongono coincide con il baricentro delle masse, si annullano automaticamente tutti i momenti magnetici di ordine pari (quadrupolo ecc.) e tutti i momenti elettrici di ordine dispari (dipolo ecc.); c) i momenti magnetici μ, espressi in magnetoni nucleari (μN), sono nulli quando I=0, mentre per I≠0 sono talvolta positivi, talvolta negativi, ossia hanno lo stesso verso o verso opposto del vettore I; i loro valori assoluti sono di solito frazioni di μN, salvo che in alcuni nuclidi di terre rare e dell’iridio, per i quali μ è dell’ordine di 6.
Trasmutazioni nucleari e radioattività artificiale
La radioattività naturale, scoperta nel 1896 da H. Becquerel, oltre a rivelare l’esistenza del n., mostra che l’atomo di un elemento chimico si può trasformare in un atomo di un altro elemento. Il primo processo di trasformazione di un n. in un altro provocato dall’uomo fu realizzato nel 1919 da E. Rutherford, il quale osservò la reazione nucleare
[9] 42He + 147N → 178O + 11p,
cioè la trasmutazione di azoto in ossigeno operata da particelle alfa. Varie altre trasmutazioni analoghe furono osservate negli anni successivi, finché, nel 1932, J. Chadwick giunse a stabilire che, bombardando il berillio con particelle alfa, si aveva emissione di neutroni. Dal fatto che dal n. venissero emessi, in opportune condizioni, sia protoni sia neutroni, si giungeva così a riconoscere che tutti i n. sono aggregati di queste due particelle. Nello stesso anno, sempre a Cambridge (Inghilterra), J. Cockroft ed E.T.S. Walton riuscirono a produrre la prima trasmutazione provocata da protoni accelerati a mezzo di un acceleratore lineare da essi stessi realizzato. L’importanza di quest’ultima scoperta non derivava soltanto dal fatto che si trattava di una trasmutazione provocata da un corpuscolo diverso dalla particella alfa, quali erano tutte le trasmutazioni osservate in precedenza: essa rappresentava anche il primo esempio di impiego di una nuova tecnica nucleare, quella delle macchine acceleratrici, o acceleratori di particelle, tecnica che, a partire dal 1932, è andata acquistando importanza sempre crescente. I n. prodotti in tutte queste trasmutazioni e in altre provocate da deutoni (21D) e da n. di elio (ossia particelle alfa) di elevata energia, prodotte a mezzo di macchine acceleratrici, osservate negli anni successivi, erano sempre stabili. Alla fine del 1933 i coniugi I. Curie e F. Joliot osservarono che bombardando con particelle alfa naturali alcuni n. leggeri, in particolare n. di boro, alluminio, magnesio, venivano prodotti nuovi nuclidi instabili per emissione di positroni.
Pochi mesi dopo la scoperta dei coniugi Curie-Joliot, E. Fermi annunciò di essere riuscito a produrre isotopi radioattivi artificiali, bombardando l’alluminio e il fluoro con neutroni. Successivamente, nuclei radioattivi artificiali furono ottenuti usando anche altri proiettili, come protoni, deutoni e raggi gamma; il caso dei neutroni, tuttavia, risultò particolarmente interessante per svariate ragioni (➔ neutrone), fra le quali: a) la grande efficienza di questo particolare proiettile, che può produrre reazioni nucleari anche in elementi di elevato numero atomico Z, come conseguenza del fatto che, essendo neutro, non risente dell’azione del campo coulombiano generato dal n.; b) il neutrone può essere rallentato facendo uso di un opportuno moderatore, fino a energie dell’ordine dell’energia di agitazione termica delle molecole, e i neutroni così rallentati, detti neutroni lenti, sono particolarmente efficaci nella produzione di alcune categorie di processi nucleari (➔ reazione).
La materia nucleare in condizioni estreme
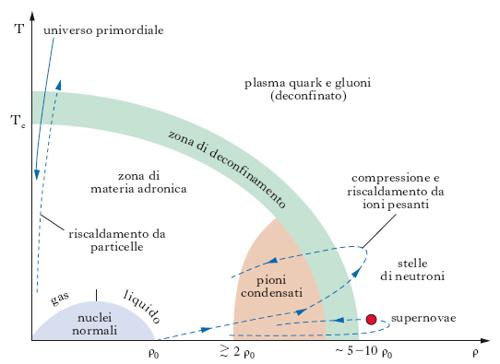
La materia nucleare può essere sollecitata in laboratorio e spinta in condizioni estreme, vicine per es. a quelle presenti nelle stelle, grazie all’impiego di acceleratori di ioni pesanti. Nella fisica degli ioni pesanti ad alta energia (con acceleratori convenzionali si è raggiunta l’energia di 200 GeV/nucleone nel sistema di riferimento del laboratorio, corrispondente a circa 20 GeV/nucleone nel centro di massa, con anelli di collisione si prevede di raggiungere energie dell’ordine di 2000 GeV/nucleone), si aggiunge energia sempre crescente in un volume abbastanza grande da contenere un numero di nucleoni sufficiente a ottenere effetti d’insieme non usuali e la formazione di un plasma di particelle primarie costituenti. Quando la velocità degli ioni supera quella del suono nella materia nucleare (pari a un quinto della velocità della luce) le compressioni e le rarefazioni che hanno luogo durante gli urti e le energie in gioco producono temperature maggiori di un milione di gradi (corrispondenti a energie cinetiche di ∼100 MeV) e la materia nucleare può sconfinare nella materia adronica (plasma di nucleoni e mesoni), fino alla formazione di un ‘magma’ di quark e gluoni: a una temperatura critica Tc∼2∙106K e a una densità da 3 a 5 volte quella dell’ordinaria materia nucleare ρ0, si dovrebbe avere una vera e propria transizione di fase della materia nucleare (fig. 7) con la formazione di un plasma di quark e gluoni nel quale i quark non sono più confinati. Si raggiunge così il confine della materia primordiale del nostro Universo negli istanti immediatamente successivi (∼10−6s) al big-bang. Lo studio di queste condizioni estreme della materia costituisce uno dei più ambiziosi traguardi della fisica nucleare.
Linguistica
In grammatica generativa, il n. della frase è costituito dai suoi componenti elementari (costituenti nucleari): soggetto e predicato verbale, eventualmente il complemento oggetto; frase nucleare è detta la frase formata dai soli componenti elementari.
Matematica
In algebra, quando si considera un morfismo tra due insiemi dotati di una stessa struttura algebrica, per es. tra due gruppi G e G′, si chiama n. del morfismo la totalità di quegli elementi di G ai quali il morfismo fa corrispondere l’elemento neutro di G′; se il morfismo si indica con ϕ: G → G′, il n. è designato con Ker ϕ. La conoscenza del n. di un morfismo è importante per l’esame del morfismo stesso: quanto più il n. è ristretto, tanto più fedelmente il morfismo rispetta la struttura di G; se il n. è ridotto al solo elemento neutro di G, si ha addirittura un isomorfismo tra G e G′ o, più esattamente, tra G e quella parte di G′ che è interessata dal morfismo.
Meteorologia
N. di condensazione
Particelle solide microscopiche, attorno alle quali il vapore acqueo atmosferico in condizione di saturazione condensa, formando goccioline d’acqua. Essi esistono in notevole quantità nell’atmosfera, dove condizionano sensibilmente la formazione e lo sviluppo delle nubi. Presentano una vastissima gamma di dimensioni e di concentrazioni. Quanto alla loro natura, essi possono consistere di cristallini di sale marino oppure di particelle provenienti dalla frantumazione delle rocce o da combustioni (fumi naturali o artificiali) e reazioni chimiche in genere (fumi di scarico di impianti industriali).
Tecnica
N. magnetico
La massa di sostanza ferromagnetica che serve, in macchine e apparecchi elettromagnetici, a convogliare il flusso di induzione magnetica.
N. polare
Elemento di materiale magnetico (ferro e acciaio fucinati o ferro laminato) che, nelle macchine elettriche rotanti a poli salienti, porta gli avvolgimenti induttori; termina con una espansione polare, in genere laminata.