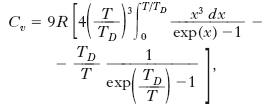Solido
Enciclopedia on line
Fisica
Stato s. Particolare stato di aggregazione della materia, caratterizzato da una notevole entità delle forze di coesione fra le particelle, in modo che ciascuna di queste risulta legata a quelle vicine da legami molto più forti che non nello stato liquido o aeriforme.
Un corpo allo stato s. si dice anche corpo s., o solido. Per la loro piccola deformabilità i s. hanno, a differenza dei liquidi e dei gas, forma e volume sensibilmente invariabili, almeno sotto sollecitazioni non troppo intense. Se si suppone tale deformabilità addirittura nulla (come per molti corpi s. si può ammettere in prima approssimazione), si ha il s. per antonomasia o s. rigido o indeformabile, in contrapposto a s. elastico, plastico ecc., qualifiche queste ultime alludenti a particolari modi di deformarsi del solido.
Fisica dello stato solido
È la parte della fisica (detta anche fisica dei s.) che si propone di spiegare le proprietà dello stato s., cioè dello stato di aggregazione della materia in cui le posizioni medie di equilibrio dei nuclei degli atomi sono fissate nello spazio; attorno a tali posizioni di equilibrio gli atomi compiono piccole oscillazioni. Gli elettroni circondano ogni nucleo come avviene negli atomi liberi, ma alcuni di essi sono condivisi tra atomi diversi e quando possono muoversi da un atomo all’altro conducono la corrente elettrica e il calore. Tutte le sostanze diventano solide in condizioni termodinamiche opportune; in generale, a una data pressione, esiste una temperatura di transizione, al disotto della quale la sostanza è solida, e al disopra della quale è allo stato liquido o gassoso.
I s. più comuni e termodinamicamente stabili sono i cristalli, caratterizzati dal fatto che le posizioni di equilibrio degli atomi che li costituiscono sono fissate in modo da riempire tutto lo spazio formando reticoli con simmetria di traslazione (cioè dato un punto qualsiasi all’interno del cristallo, traslando quel punto di un vettore τ, multiplo secondo numeri interi dei tre vettori che definiscono una cella elementare τ1, τ2, τ3, ci si riconduce a un altro punto del cristallo con le stesse caratteristiche fisiche, indistinguibile dal precedente). Oltre ai cristalli, esistono s. con un grado di ordine minore, anche se non sono termodinamicamente i più stabili. I policristalli sono composti da cristalli microscopici con simmetria di traslazione a breve distanza, ma il cui orientamento varia a grandi distanze. I s. amorfi hanno posizioni degli atomi fisse nello spazio, ma determinabili solo con una certa probabilità; i vetri sono esempi di s. amorfi con grande disordine. Un’altra possibilità di disordine si ha nel caso delle leghe (leghe metalliche o leghe di semiconduttori); in esse i cristalli sono costituiti da due o più componenti atomici in proporzioni variabili (per es., AxB1–x per due componenti), le posizioni occupate nello spazio sono uguali a quelle di un cristallo, ma non è noto quale dei due atomi si trovi in una certa posizione.
La maggior parte degli studi teorici a livello microscopico riguarda i cristalli, perché la simmetria di traslazione è di grande aiuto e agevola i calcoli delle grandezze fisiche, particolarmente quando si deve usare la meccanica quantistica. Inoltre, i risultati ottenuti sui cristalli servono come base e punto di partenza per la comprensione di altri s. più complessi; l’effetto del disordine reticolare viene considerato separatamente come generatore di particolari fenomeni.
Classificazione dei solidi
Una classificazione razionale dei s. può essere ottenuta considerando le proprietà del trasporto di corrente elettrica e le proprietà ottiche a esse collegate. I s. possono in tal modo essere distinti in metalli, isolanti e semiconduttori. La spiegazione delle differenze di comportamento alla base di questa suddivisione è immediata alla luce della struttura generale delle bande di energia degli elettroni (➔ banda) e del numero di elettroni disponibili per occupare gli stati quantici secondo la statistica di Fermi-Dirac.
I metalli sono caratterizzati dal fatto che gli elettroni di valenza occupano gli stati in modo che il livello di Fermi (che allo zero assoluto separa i livelli energetici occupati da quelli vuoti) cada all’interno di una banda permessa. In presenza di un campo elettrico gli elettroni possono trasferirsi su stati permessi vicini, acquistando una quantità di moto media diversa da zero nella direzione del campo e dando luogo a una corrente elettrica. La resistenza del metallo al passaggio della corrente è dovuta principalmente alle collisioni degli elettroni con gli ioni del reticolo cristallino (descrivibili in termini di interazioni elettrone-fonone) che producono dissipazione di energia nel trasporto; queste interazioni inoltre fanno sì che la dipendenza dalla resistività della temperatura sia lineare in un intervallo di temperatura abbastanza ampio. Il metallo assorbe la luce sempre, perché esistono stati vuoti nella banda di conduzione ai quali gli elettroni possono essere trasferiti dai fotoni (anche i fononi partecipano a queste transizioni). Sono necessariamente metalli tutti gli elementi i cui atomi contribuiscono con un numero dispari di elettroni (detti elettroni di valenza) al legame chimico e cristallizzano con un solo atomo per cella elementare, perché in tal caso, essendo per ogni banda il numero degli stati doppio del numero di celle elementari a causa della degenerazione di spin, il livello di Fermi deve necessariamente cadere all’interno di una banda. Spesso la struttura a bande è complicata dalla sovrapposizione di due o più bande e possono avere carattere metallico anche altri elementi.
Gli isolanti sono caratterizzati dal fatto che delle due bande di energia più vicine al livello di Fermi, quella inferiore ha tutti i livelli occupati dagli elettroni di valenza e quella superiore ha tutti gli stati vuoti. Le due bande sono separate da un intervallo proibito di energia Eg; alle temperature ordinarie Eg≫kT con k costante di Boltzmann e T temperatura termodinamica. Gli elettroni non possono cambiare la loro quantità di moto medio sotto l’effetto di un campo elettrico esterno per mancanza di stati vuoti accessibili nella banda di valenza. Per portare gli elettroni nella banda di conduzione (vuota) sono necessari campi elettrici che forniscano energia sufficiente a superare l’intervallo proibito Eg, così elevati da causare il fenomeno della rottura del dielettrico per collisioni ionizzanti a valanga. Gli isolanti sono generalmente trasparenti alla luce, perché l’assorbimento di un fotone ha luogo solo se hν>Eg ed essendo Eg dell’ordine di alcuni elettronvolt l’assorbimento inizia nell’ultravioletto; all’assorbimento possono concorrere anche stati vibrazionali, ma le loro frequenze caratteristiche cadono nell’infrarosso lontano. Sono isolanti molti cristalli elementari, quali quelli costituiti da atomi con orbite esterne completamente occupate, i cristalli ionici che possono essere rappresentati da due sottoreticoli rispettivamente di ioni positivi e negativi, i cristalli a legame idrogeno.
I semiconduttori sono dal punto di vista della struttura elettronica molto simili agli isolanti, solo che sono caratterizzati da un valore di Eg sufficientemente basso (tipicamente inferiore a 2 eV) con conseguenze notevoli nelle proprietà ottiche e di trasporto. I semiconduttori si comportano infatti come gli isolanti a bassa temperatura e divengono conduttori quando la temperatura è sufficientemente elevata da consentire per eccitazione termica l’esistenza di elettroni nella banda di conduzione e di lacune o buche nella banda di valenza. Tipici semiconduttori sono gli elementi del gruppo IV, come il silicio e il germanio.
Teoria dei calori specifici dei solidi
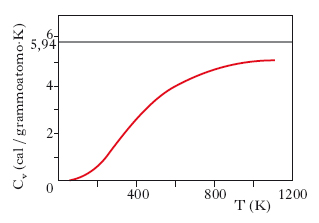
Un pur breve approfondimento merita per la sua rilevanza storica la teoria dei calori specifici dei s. elaborata da A. Einstein nel 1907. La legge di Dulong e Petit, enunciata nel 1819, stabilisce che il calore atomico è lo stesso per tutte le sostanze pure. A temperature ordinarie tale legge risulta valida per molti elementi, essendo tale valore compreso tra 5,38 e 6,93 calorie per grammoatomo contro 5,94 calorie (24,9 joule) per grammoatomo quale valore teoricamente previsto. Esistono tuttavia molte eccezioni; in particolare il boro, il berillio, il carbonio nella struttura a diamante, il silicio mostrano per il calore atomico valori sensibilmente inferiori a quello previsto dalla legge di Dulong e Petit. Inoltre va osservato che contrariamente a quanto prevede la legge suddetta, per tutte le sostanze solide i calori specifici variano con la temperatura, diminuendo al diminuire di quest’ultima. Un tipico esempio di un tale comportamento è mostrato in fig. 1, dove è rappresentato l’andamento del calore specifico a volume costante Cv, in funzione della temperatura, per il diamante. Una prima spiegazione di tale variazione con la temperatura fu data da A. Einstein; questi, considerando gli atomi costituenti il s. come oscillatori atomici con tre gradi di libertà, sostituendo per ognuno di essi il valore classico dell’energia media kT (k costante di Boltzmann, T temperatura termodinamica) con quello quantistico ottenuto ammettendo che l’energia degli oscillatori potesse assumere solo valori pari a multipli interi di hν (h costante di Planck, ν frequenza propria degli oscillatori), determinò l’energia U di un grammoatomo, da cui derivò per il calore specifico a volume costante l’espressione
dove R è la costante dei gas. Questa espressione per Cv, pur avvicinandosi molto ai risultati sperimentali, non risulta particolarmente soddisfacente per temperature prossime allo zero assoluto.
Una teoria più completa fu proposta successivamente da P. Debye (➔). Egli considerò lo stato di vibrazione di un s. come dovuto alla sovrapposizione di più modi normali indipendenti quantizzati, in numero pari a 3N (essendo N il numero di atomi), e di due tipi diversi, longitudinali e trasversali, dello stesso tipo cioè delle vibrazioni elastiche che possono aversi in un solido. Sotto tali ipotesi, si ottiene:
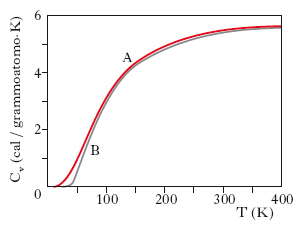
dove TD è la temperatura di Debye. Ad alte temperature Cv tende al valore classico 3R, mentre a basse temperature si ha, con buona approssimazione, Cv≅(T/TD)3. Tale andamento con la temperatura risulta abbastanza ben verificato dai dati sperimentali. In fig. 2 sono indicate le curve teoriche di Debye (A) e di Einstein (B) nel caso dell’alluminio.
Matematica
Figura geometrica solida (a tre dimensioni) giacente nello spazio; i s. platonici sono i poliedri regolari, e i s. archimedei i poliedri archimedei (➔ poliedro). Si chiama s. di rotazione la porzione di spazio descritta da un’area piana che ruota attorno a un asse.
Tecnica
Nelle costruzioni stradali, si chiama s. stradale, relativo a un certo tronco di strada, il volume delimitato dal piano di campagna preesistente alla costruzione della strada, dalla piattaforma e dalle scarpate laterali della strada stessa (➔ strada).
© Istituto della Enciclopedia Italiana - Riproduzione riservata